题目内容
20.镁铝合金5.1g溶于500mL 1mol/L的盐酸中,向反应后的溶液中加入过量 NaOH溶液,最终生成5.8g白色沉淀.下列有关说法不正确的是( )| A. | 白色沉淀为Mg(OH)2 | |
| B. | 在加入NaOH过程中生成沉淀最多为13.6g | |
| C. | 生成H2体积为5.6L | |
| D. | 刚加NaOH 溶液就有沉淀生成 |
分析 发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,溶液中n(HCl)=0.5L×1mol/L=0.5mol,向反应后的溶液中加入过量NaOH溶液,发生反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl,AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaCl=铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),由此分析解答.
解答 解:A、加入过量的氢氧化钠,铝元素转化为偏铝酸根离子,而氢氧化镁不溶于氢氧化钠,所以白色沉淀为Mg(OH)2,故A正确;
B、5.8g的氢氧化镁的物质的量为:0.1mol,所以镁的物质的量为0.1mol,其质量为2.4g,所以铝的质量为5.1-2.4=2.7g,物质的量为0.1mol,所以生成沉淀最大量为:5.1+0.1×(2+3)×17=13.6g,故B正确;
C、状况不知,无法求气体的体积,故C错误;
D、0.1mol的铝消耗0.3mol的盐酸,0.1mol的镁消耗0.2mol的盐酸,所以5.1g溶于500mL 1mol/L的盐酸中恰好完全反应生成氯化镁和氯化铝,则向所得溶液中刚加NaOH 溶液就有沉淀生成,故D正确;
故选C.
点评 本题考查混合物的有关计算,难度中等,注意从电子转移守恒计算n(OH-)是关键.

练习册系列答案
相关题目
10.铅蓄电池是常见的二次电池,某学生用铅蓄电池进行下列实验,如图所示.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列判断错误的是( )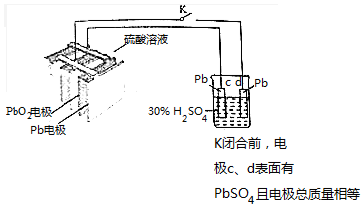

| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |
11.电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )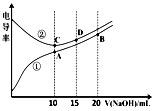

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
8.下列不属于碱的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 熟石灰 | D. | 一水合氨 |
15.化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |
5.下列有关元素性质的递变规律不正确的是( )
| A. | Na、Mg、Al的金属性依次减弱 | B. | H2S、H2O、HF的稳定性依次减弱 | ||
| C. | Cl-、Br-、I- 还原性依次增强 | D. | Na、K、Rb的原子半径依次增大 |
9.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素.苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如图: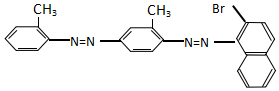
下列关于“苏丹红4号”说法正确的是( )

下列关于“苏丹红4号”说法正确的是( )
| A. | 不能发生加成反应 | B. | 属于甲苯同系物 | ||
| C. | 属于芳香烃 | D. | 能发生水解反应 |
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.