题目内容
14. 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.Ⅰ、V2O5是接触法制硫酸的催化剂.图为硫酸生产过程中2SO2 (g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1反应过程的能量变化示意图.
(1)V2O5的使用会使图中B点降低(填“升高”、“降低”、“不变”下同),C点不变.
(2)一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为a+bmol/L;生成SO3的化学反应速率为$\frac{b}{t}$mol/(L•min).(用a和b表示)
(3)已知1g固体S完全燃烧生成SO2气体放出9.3kJ热量,写出S的燃烧热的热化学方程式S(s)+O2(g)=SO2(g),△H=-297.6kJ/mol.
分析 (1)B为活化能,活化能的大小与反应热无关,加催化剂降低反应所需的活化能;但不影响反应热;
(2)根据化学平衡三段式列式计算,结合计算公式,c=$\frac{n}{V}$;v=$\frac{△c}{△t}$;
(3)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
解答 解:(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关,加催化剂降低反应所需的活化能,该反应通常用V2O5作催化剂,则加V2O5会使图中B点降低;但不影响反应热,故C点不变;
故答案为:降低;不变;
(2)一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,依据化学平衡三段式列式计算;
2SO2 (g)+O2(g)?2SO3(g)
起始量(mol/L) a+b 0
变化量(mol/L) b 0.5b b
tmin量(mol/L) a b
则SO2起始物质的量浓度为(a+b)mol/L,生成SO3的化学反应速率=$\frac{bmol/L}{tmin}$=$\frac{b}{t}$mol/L•min;
故答案为:a+b;$\frac{b}{t}$;
(3)1g固体S完全燃烧生成SO2气体放出9.3kJ热量,即1molS完全燃烧时放出放出32×9.3kJ=297.6kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g),△H=-297.6kJ/mol,
故答案为:S(s)+O2(g)=SO2(g),△H=-297.6kJ/mol.
点评 本题考查了催化剂的作用,利用三段式求化学反应速率以及起始浓度,以及热化学方程式书写,掌握基础是关键,题目难度中等.

| A. | 白色沉淀为Mg(OH)2 | |
| B. | 在加入NaOH过程中生成沉淀最多为13.6g | |
| C. | 生成H2体积为5.6L | |
| D. | 刚加NaOH 溶液就有沉淀生成 |
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ•mol-1) | 497 | 803 | 1072 |
| A. | 中子数为8的氮原子${\;}_{7}^{8}$N | |
| B. | 钠原子的结构示意图: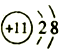 | |
| C. | 氧化钠的电子式: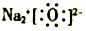 | |
| D. | 2-戊烯的结构简式:CH3CH2CH═CHCH3 |
| A. | 107g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 1L 0.1 mol•L-1Na2CO3溶液中CO32-和HCO3-离子数之和为0.1 NA | |
| C. | 密闭容器中0.5mol H2与0.5mol I2充分反应,得到HI的分子数为NA | |
| D. | 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA |
| A. | D216O、HTl6O共10g,所含分子数为0.25NA | |
| B. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 常温下1L0.1 mol/L A1C13溶液中阳离子数大于0.1NA | |
| D. | 1L0.1 mol/L Fe(NO3)3溶液参加反应,最多转移电子数为0.3NA |
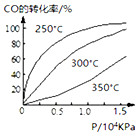 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.