题目内容
16.为测定某有机化合物A的结构,进行如下实验.【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是2:6:1;
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是C2H6O;
(3)根据价键理论,预测A的可能结构并写出结构简式CH3CH2OH或CH3OCH3.
【结构式的确定】
(4)核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl-CH2-O-CH3)有两种氢原子(图1).经测定,有机物A的核磁共振氢谱示意图如图2,则A的结构简式为CH3CH2OH

【性质实验】
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:
 .
.(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:nCH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式:
 .
.
分析 (1)浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,以此可确定有机物中C、H原子个数比值,结合消耗氧气的体积可确定有机物中各原子个数比值;
(2)根据有机物原子个数比值可确定最简式,结合相对分子质量可确定有机物分子式;
(3)根据有机物分子式结合价键理论可确定有机物的可能结构;
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,二甲醚只有一种不同化学环境的氢原子;
(5)A为乙醇在一定条件下脱水可生成B为乙烯,乙烯可合成包装塑料C为聚乙烯;
(6)用B选择合适的方法制备氯乙烷,要求原子利用率为100%,是利用乙烯和氯化氢加成反应得到氯乙烷;
(7)反应为乙酸与乙醇的酯化反应.
解答 解:(1)由题意可知n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(O2)=$\frac{0.67L}{22.4L/mol}$=0.3mol,
根据氧原子守恒可知有机物中含有n(O)=0.3mol+0.2mol×2-0.3mol×2=0.1mol,
则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,
故答案为:2:6:1;
(2)该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1,则最简式为C2H6O,其相对分子质量为46,则有机物的分子式为C2H6O,
故答案为:C2H6O;
(3)有机物的分子式为C2H6O,分子中可能存在C-C、C-H、C-O、O-H等化学键,可能的结构简式有CH3CH2OH或CH3OCH3,
故答案为:CH3CH2OH或CH3OCH3.
(4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,即CH3CH2OH,二甲醚只有一种不同化学环境的氢原子,
故答案为:CH3CH2OH;
(5)A为乙醇在一定条件下脱水可生成B为乙烯,乙烯可合成包装塑料C为聚乙烯,反应的化学方程式为: ,
,
故答案为: ;
;
(6)用B选择合适的方法制备氯乙烷,要求原子利用率为100%,是利用乙烯和氯化氢加成反应得到氯乙烷,反应的化学方程式为:nCH2=CH2+HCl $\stackrel{催化剂}{→}$ CH3CH2Cl,
故答案为:nCH2=CH2+HCl $\stackrel{催化剂}{→}$ CH3CH2Cl;
(7)发生一系列的化学变化而变得更醇香,应为乙醇被氧化为乙酸,进而发生酯化反应生成乙酸乙酯,反应的方程式为 ,
,
故答案为: ;
;
点评 本题考查有机物的推断,题目难度不大,本题注意从质量守恒的角度判断有机物最简式,是解答该题的关键.

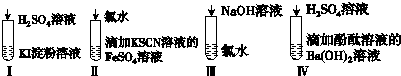
| 选项 | 现象 | 离子方程式 |
| A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由浅绿色变为红色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 颜色无变化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 易溶于水 | D. | 熔化时能导电 |
①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③④⑤ |
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 |
B.用标准溶液润洗滴定管2-3次 |
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 |
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm |
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B-
(2)滴定开始后,眼睛注视 ,判断到达终点的现象是 。
(3)下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。


 与
与 G.
G. 与
与 
 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为 .
.