题目内容
现有室温下浓度均为1×10-3mol/L的几种溶液:
①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ________ ⑥(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH ________ 7(填“>”、“<”或“=”)
用离子方程式说明其原因 _______________________
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的为________ (填写序号)
最终产生H2总量的关系为___________(填写序号)
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① _________ ③(填“>”、“<”或“=”)
(5)将等体积的⑤、⑥溶液加热至同温度后,溶液的pH ⑤ _____ ⑥(填“>”、“<”或“=”)
(1)> ;c(Na+)="c" (CH3COO-)> c(H+)="c" c(OH-).
(2)< NH4++H2O NH3·H2O+H+ (3)②>①>③; ②>①=③ ;(4)< (5)<
NH3·H2O+H+ (3)②>①>③; ②>①=③ ;(4)< (5)<
解析试题分析:(1)由于醋酸是弱酸,NaOH是强碱,所以将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③>⑥; 根据电荷守恒可得:c(Na+)+c(H+)="c" (CH3COO-)+c(OH-),由于溶液呈中性, c(H+)="c" c(OH-),所以c(Na+)="c" (CH3COO-),在盐溶液中盐电离远大于弱电解质水的电离作用,所以c(Na+)="c" (CH3COO-)> c(H+)="c" c(OH-);(2)由于HCl是强酸,NH3·H2O是弱碱,所以将等体积的①、⑤混合,则恰好完全发生产生盐NH4Cl,该盐是强酸弱碱盐,NH4+水解消耗水电离产生的OH-,最终使溶液中的H+的浓度大于OH-,所以溶液显酸性,pH<7,水解的离子方程式是NH4++H2O NH3·H2O+H+;(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,由于溶液中c(H+)关系是:②>①>③,所以反应的初始速率由快到慢的为②>①>③,因为硫酸是二元酸,而盐酸和醋酸是一元酸,所以最终产生H2总量的关系为②>①=③ ;(4)盐酸是强酸,完全电离,而醋酸是弱酸,部分电离,在溶液中存在电离平衡,当向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,由于会对醋酸的电离平衡起抑制作用,所以醋酸的酸性比原来还小,混合液的pH 大小关系为①<③; (5)NH3·H2O是弱碱,部分电离,而NaOH是强碱,完全电离,所以溶液中离子的浓度NaOH>NH3·H2O故溶液的pH ⑤ <⑥。
NH3·H2O+H+;(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,由于溶液中c(H+)关系是:②>①>③,所以反应的初始速率由快到慢的为②>①>③,因为硫酸是二元酸,而盐酸和醋酸是一元酸,所以最终产生H2总量的关系为②>①=③ ;(4)盐酸是强酸,完全电离,而醋酸是弱酸,部分电离,在溶液中存在电离平衡,当向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,由于会对醋酸的电离平衡起抑制作用,所以醋酸的酸性比原来还小,混合液的pH 大小关系为①<③; (5)NH3·H2O是弱碱,部分电离,而NaOH是强碱,完全电离,所以溶液中离子的浓度NaOH>NH3·H2O故溶液的pH ⑤ <⑥。
考点:考查溶液中两种浓度的大小比较、还小反应速率的计算、溶液的酸碱性的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于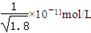 |
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
常温下,下列各组比值为1∶2的是
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
(10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用下图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有 (多选扣分):
A 配制标准溶液定容时,加水超过刻度 B 锥形瓶水洗后直接装待测液
C 酸式滴定管水洗后未用待测稀盐酸溶液润洗 D 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
(8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列(填序号)。 |
铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 | 9.6 |
| 完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 | 12.4 |
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
 w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m