题目内容
(1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
(1) < (2) > (3) 不变 (4)减小
解析试题分析:(1)由于氨水是弱电解质,所以在PH值相同的情况下。氨水消耗酸的体积比较大。(2)由于醋酸是属于弱酸,所以在PH值相同的情况下,醋酸的浓度大于硫酸。(3)溶解平 衡常数只与温度有关。所以Ksp(AgCl)不变。(4)加入氯化铵之后,铵根离子增加。反应向氨水的电离的反方向移动,所以氨水的电离程度减小
考点:考查弱电解质的相关知识点

练习册系列答案
相关题目
对于室温下pH=3的醋酸,下列叙述正确的是
| A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强 |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变 |
| D.与等体积pH=11的NaOH溶液混合后,pH=7 |
室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
| B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7 |
(9分)下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
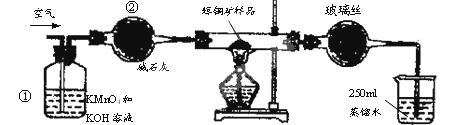
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
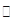 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。

 N2(g)+2CO2(g)的△H是______。
N2(g)+2CO2(g)的△H是______。