题目内容
11.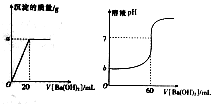 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)根据实验记录回答下列问题:
(1)a=0.233g,b=0.5
(2)加入0~20mLBa(OH)2溶液阶段中发生反应的离子方程式H++OH-=H2O、Ba2++SO42-=BaSO4↓
(3)原混合溶液中H2SO4的物质量的量的浓度为0.05mol•L-1,HCl的物质的量的浓度为0.2mol•L-1
(4)加入20mL氢氧化钡溶液时,溶液的pH=1.
分析 (1)根据图象可知,当加入20mLBa(OH)2溶液时,沉淀的量达到最大值为ag,求出Ba(OH)2的物质的量,然后根据1molBa(OH)2~1molBaSO4来分析计算BaSO4的物质的量和质量;
根据当个加入60mLBa(OH)2溶液时,溶液的pH=7,即溶液显中性,可知此时酸溶液中的n(H+)等于60mLBa(OH)2溶液中的n(OH-),据此计算c(H+)和pH;
(2)加入0~20mLBa(OH)2溶液时,酸溶液中的氢离子和氢氧根发生中和反应生成水,Ba2+和SO42-反应生成BaSO4沉淀,据此书写离子方程式;
(3)当加入20mL氢氧化钡溶液时,溶液显酸性,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$来计算.
解答 解:(1)根据图象可知,当加入20mLBa(OH)2溶液时,沉淀的量达到最大值为ag,此时消耗的Ba(OH)2的物质的量n=CV=0.05mol/L×0.02L=0.001mol,而1molBa(OH)2~1molBaSO4,故可知生成的BaSO4的物质的量n(BaSO4)=n(Ba(OH)2)=0.001mol,则质量m=nM=0.001mol×233g/mol=0.233g;
根据当个加入60mLBa(OH)2溶液时,溶液的pH=7,即溶液显中性,可知此时酸溶液中的n(H+)等于60mLBa(OH)2溶液中的n(OH-),即酸溶液中的n(H+)=0.05mol/L×0.06L×2=0.006mol,则酸溶液中的c(H+)=$\frac{0.006mol}{0.02L}$=0.3mol/L,则pH=-lg0.3=0.5;
故答案为:0.233g;0.5;
(2)加入0~20mLBa(OH)2溶液时,酸溶液中的氢离子和氢氧根发生中和反应生成水:H++OH-=H2O,Ba2+和SO42-反应生成BaSO4沉淀:Ba2++SO42-=BaSO4↓,故答案为:H++OH-=H2O、Ba2++SO42-=BaSO4↓;
(3)当加入20mLBa(OH)2溶液时,沉淀的量达到最大值,即Ba2+将SO42-沉淀完全,故可知:溶液中的n(H2SO4)=n(Ba(OH)2)=0.001mol,则硫酸的物质的量浓度c=$\frac{0.001mol}{0.02L}$=0.05mol/L;故硫酸提供的c(H+)=0.1mol/L,而酸溶液中的氢离子总浓度为0.3mol/L,故由盐酸电离出的氢离子浓度为0.2mol/L,故c(HCl)=0.2mol/L.
故答案为:0.05mol/L;0.2mol/L;
(4)当加入20mL氢氧化钡溶液时,溶液显酸性,故混合后溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$=$\frac{0.006mol-0.1mol/L×0.02L}{0.04L}$=0.1mol/L,则pH=-lg0.1=1.
故答案为:1.
点评 本题考查了酸碱混合后溶液的pH的有关计算和沉淀量的计算,难度较大,综合性较强,应注意的是混合后溶液显什么性就先求什么离子的浓度.

| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
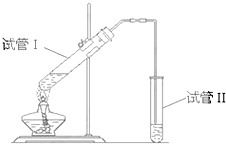 如图所示装置,该装置用于制备少量乙酸乙酯,请回答:
如图所示装置,该装置用于制备少量乙酸乙酯,请回答: