题目内容
12.把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Mg2+的浓度为( )| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
分析 混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y;一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol;
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=n(BaSO4)=n(BaCl2),再利用电荷守恒可知每份中2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,据此计算每份中n(Mg2+),根据c=$\frac{n}{V}$计算镁离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y,
一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol,
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=BaSO4=n(BaCl2)=bmol;
由电荷守恒可知每份中:2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,
联立①②解得:x=$\frac{8b-3a}{2}$mol、y=(a-2b)mol,
每份溶液的体积为0.5VL,则每份混合溶液中Mg2+的浓度为:c(Mg2+)=$\frac{\frac{8b-3a}{2}mol}{0.5VL}$=$\frac{8b-3a}{V}$mol/L,
溶液具有均一性,则原混合液中镁离子的浓度为:$\frac{8b-3a}{V}$mol/L,
故选B.
点评 本题考查了混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | Cl-、Na+、SO42-、Al3+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | Fe2+、Mg2+、NO3-、Cl- |
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③升高温度会加快反应速率,原因是增加了活化分子百分数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
| A. | NaNO2是氧化剂 | |
| B. | NH4Cl中的氮元素被氧化 | |
| C. | 每生成1 mol N2转移的电子的物质的量为6 mol | |
| D. | N2既是氧化剂,又是还原剂 |
| A. | 用焰色反应鉴别NaCl、K2CO3 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 |
| A. | 新制氯水 | B. | 溴水 | C. | 碘水 | D. | 氯化钠溶液 |
①CSO的电子式:
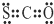
②对硝基苯酚的结构简式:
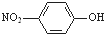
③Cl-的结构示意图:
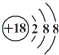
④苯分子的比例模型:

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+( )
| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |