题目内容
11.已知:H2SO3+Br2+H2O═HBr+H2SO4.现将0.03molCl2缓缓通入含0.02molH2SO3和0.02molHBr的混合溶液中,在此过程中,溶液的c(H+)与Cl2用量的关系示意图是( )(不考虑溶液的体积变化)| A. | 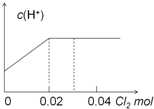 | B. | 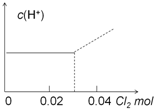 | ||
| C. | 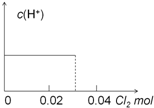 | D. | 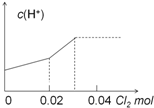 |
分析 根据方程式知,还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.02mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.02mol,
亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,溶液中c(H+)不变.
解答 解:根据方程式知,还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.02mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.02mol,亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,所以该过程中氢离子浓度不变,即横坐标增大而纵坐标不变,
故选A.
点评 本题以物质之间的反应为载体考查氧化还原反应的计算、强弱电解质等知识点,明确方程式中各个物理量之间的关系是解本题关键,注意氯气和HBr反应时氢离子浓度不变,为易错点.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
1.下列反应属于取代反应的是( )
| A. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| B. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| C. | 乙酸与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| D. | 苯与氯气在一定条件下反应生成六六六(化学式C6H6Cl6) |
2.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | Cl-、Na+、SO42-、Al3+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | Fe2+、Mg2+、NO3-、Cl- |
19.下列叙述正确的是( )
| A. | O2和O3互为同位素,性质相似 | |
| B. | 等质量的碳酸钠和碳酸氢钠粉末分别与足量同浓度的稀盐酸反应,前者产生的二氧化碳多,后者产生二氧化碳的速率慢 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | 浓硫酸通常可用铝槽车来运输 |
6.下列物质的变化中,发生了氧化反应的是( )
| A. | MnO4-→Mn2+ | B. | H2S→SO2 | C. | CuO→Cu | D. | Fe3+→Fe2+ |
3.下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③升高温度会加快反应速率,原因是增加了活化分子百分数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③升高温度会加快反应速率,原因是增加了活化分子百分数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
20.实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法错误的是( )
| A. | NaNO2是氧化剂 | |
| B. | NH4Cl中的氮元素被氧化 | |
| C. | 每生成1 mol N2转移的电子的物质的量为6 mol | |
| D. | N2既是氧化剂,又是还原剂 |