题目内容
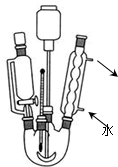
13. 在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点气体的平均相对分子质量:A>C |
分析 N2O4(g)═2NO2(g)△H=+57kJ•mol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
A、A、C两点都在等温线上,压强越大,反应速率越快;
B、在体积恒定的密闭容器中,增大压强,即增大物质的浓度;
C、压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
D、增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,据此判断.
解答 解:A.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故A错误;
B.在体积恒定的密闭容器中,增大压强,即增大物质的浓度,所以C点的浓度大,A点的浓度小,则A、C两点气体的颜色:A浅,C深,故B错误;
C.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故C正确;
D.由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:A<C,故D错误;
故选:C.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化.

练习册系列答案
相关题目
3.下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③升高温度会加快反应速率,原因是增加了活化分子百分数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③升高温度会加快反应速率,原因是增加了活化分子百分数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
4.下列有关化学用语表示正确的是
①CSO的电子式: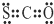
②对硝基苯酚的结构简式: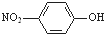
③Cl-的结构示意图: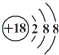
④苯分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+( )
①CSO的电子式:
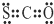
②对硝基苯酚的结构简式:

③Cl-的结构示意图:

④苯分子的比例模型:

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+( )
| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
18.下列有关元素及其化合物的叙述中正确的是( )
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,无CaCO3沉淀产生 | |
| B. | SO2具有漂白性,将过量SO2气体通入紫色石蕊试液时,石蕊试液先变红后褪色 | |
| C. | CO、SO2、NO2都是对大气产生污染的气体,它们的空气中都能稳定存在 | |
| D. | 类比(比较)是研究物质性质的常用办法之一,可预测许多物质的性质.例如:将SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
5.FeCO3与砂糖混用可以作补血剂,实验室制备FeCO3的流程如图所示,下列说法正确的是( )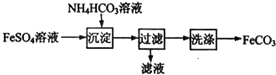

| A. | 过滤操作中所用的玻璃仪器只有烧杯和漏斗 | |
| B. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| C. | 可利用HNO3酸化的BaCl2溶液检验FeSO4溶液中的阴离子 | |
| D. | 沉淀过程中有CO2气体放出 |
2.相同状况下,4体积NO2与1.5体积O2混合通过适量水,收集到的气体体积为( )
| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |