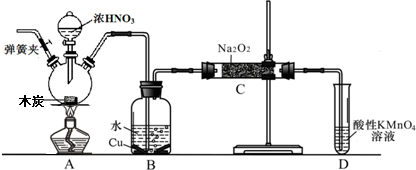
题目内容
6.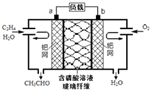 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
分析 由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答 解:A.a电极通入的是CH2=CH2,CH2=CH2被氧化发生氧化原反应,故A错误;
B.由负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+可知,每转移2mol电子,理论上需要消耗1mol,即28g乙烯,故B正确;
C.正极发生还原反应,因为电解质溶液呈酸性,所以电极方程式为O2+4H++4e-═2H2O,故C错误;
D.电子只能经过导线,不能经过溶液,故D错误;
故选B.
点评 本题考查了原电池原理的应用,注意掌握原电池中电极的判断方法和电极方程式的书写是解决本题的关键,易错点为D,注意电子不能流经溶液,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
17.下列溶液滴加到淀粉碘化钾试纸上,试纸不显蓝色的是( )
| A. | 新制氯水 | B. | 溴水 | C. | 碘水 | D. | 氯化钠溶液 |
14.设N A为阿伏加德罗常数的值.下列说法正确的是( )
| A. | NO2和N2O4组成的46g混合气体中氮原子的数目为NA | |
| B. | 1molC2H2分子中含有σ键的数目为2NA | |
| C. | HClO光照分解产生22.4LO2,转移的电子数为4NA | |
| D. | 常温下,1L0.1mol/LFe2(SO4)3溶液中阳离子数小于0.2NA |
18.下列有关元素及其化合物的叙述中正确的是( )
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,无CaCO3沉淀产生 | |
| B. | SO2具有漂白性,将过量SO2气体通入紫色石蕊试液时,石蕊试液先变红后褪色 | |
| C. | CO、SO2、NO2都是对大气产生污染的气体,它们的空气中都能稳定存在 | |
| D. | 类比(比较)是研究物质性质的常用办法之一,可预测许多物质的性质.例如:将SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
15.欲配制1mol•L-1溶液250mL,需质量分数为98%密度为1.84g•mL-1的浓H2SO4的体积约为( )
| A. | 13.6mL | B. | 1.36mL | C. | 13.9mL | D. | 1.39mL |
9.2A(g)?2B(g)+C(g);正反应吸热,达平衡时,要使v(正)增大、c(A)减小,应采取( )
| A. | 加压 | B. | 减压 | C. | 减小B的浓度 | D. | 升温 |