题目内容
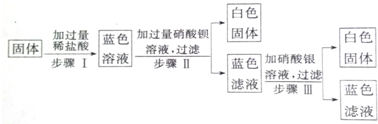
8.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解.
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是Na2CO3,一定不含有的物质是Na2SO4、CuSO4、CaCl2,可能含有的物质是NaCl(以上空格均填化学式).
(2)写出步骤③中的离子方程式BaCO3+2H+=Ba2++CO2↑+H2O.
分析 ①硫酸铜溶液是蓝色的,而白色固体加水得到了无色溶液,故固体中一定不含有CuSO4;
②碳酸钠能与硝酸钡反应生成碳酸钡沉淀,硫酸钠能与硝酸钡反应生成硫酸钡沉淀;
③碳酸钡可溶于硝酸,而硫酸钡不溶于稀硝酸,根据物质的性质进行分析,即可解答.
解答 解:①取固体混合物样品溶于水搅拌后得到无色溶液,由于硫酸铜溶液为蓝色,说明一定不含CuSO4;
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成,根据题干给出的物质,所形成的沉淀可能为碳酸钡或硫酸钡,所以混合物中可能含碳酸钠或硫酸钠,也可能是二者的混合物;
③在白色沉淀中加入足量的稀硝酸,发现沉淀全部溶解,碳酸钡可溶于硝酸,而硫酸钡不溶于稀硝酸,说明沉淀为碳酸钡,故一定含有碳酸钠,一定没有硫酸钠,而碳酸钠可与氯化钙形成沉淀,而①中样品溶于水得到无色溶液,故混合物中一定不含氯化钙;氯化钠是否存在无法确定;
(1)根据分析可知原混合物中一定含有的物质是Na2CO3,一定不含有的物质是CuSO4、Na2SO4、CaCl2,可能含有的物质是NaCl,故答案为:;CuSO4、Na2SO4、CaCl2;NaCl;
(2)步骤③中碳酸钡白色溶液溶解于稀硝酸,发生反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
点评 本题为物质推断题,可以依据物质的性质结合题干提供的信息进行解答,抓住题干叙述中沉淀等反应特征是解题突破口,题目较简单.

练习册系列答案
相关题目
2.下列说法中,不正确的是( )
| A. | 氧化铝陶瓷和光导纤维都是无机非金属材料 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 使用氢能源替代化石燃料可减少CO2排放 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
3.要使Ba2+、Al3+、Cu2+、Mg2+、Ag+五种离子从混合液中逐一沉淀析出,下列选用的试剂和加入的顺序正确的是( )
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
20.铅蓄电池放电时发生下列变化,负极:Pb+SO42--2e-=PbSO4 正极:4H++SO42-+PbO2+2e-═PbSO4+2H2O 使用该电池电解硫酸铜溶液,要得到纯铜1.6 g,需消耗该电池内硫酸的物质的量为 ( )
| A. | 0.05 mol | B. | 0.25 mol | C. | 0.1 mol | D. | 1 mol |
 在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题:
在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题: .
.