题目内容
(1)在标准状况下,22g CO2气体的体积是 L,与 g N2含有相同的分子数.
(2)等质量的CO和CO2其物质的量之比是 .
(3)100mL 1mol?L-1Al2(SO4)3溶液中,含SO42-离子 个.
(4)已知反应:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O 该反应中H2O2只发生如下变化过程:H2O2→O2该反应中的还原剂是 .若产生的气体在标准状况下体积为3.36L,则反应中转移了 mol电子.
(2)等质量的CO和CO2其物质的量之比是
(3)100mL 1mol?L-1Al2(SO4)3溶液中,含SO42-离子
(4)已知反应:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O 该反应中H2O2只发生如下变化过程:H2O2→O2该反应中的还原剂是
考点:物质的量的相关计算,氧化还原反应
专题:计算题
分析:(1)根据n=
计算二氧化碳的物质的量,根据V=nVm计算二氧化碳的体积,根据m=nM计算氮气的质量;
(2)根据n=
计算CO和CO2的物质的量之比;
(3)根据n=cV计算硫酸铝的物质的量,硫酸根物质的量为硫酸铝的物质的量,根据N=nNA计算硫酸根数目;
(4)所含元素化合价升高的反应物是还原剂;根据n=
计算氧气的物质的量,结合氧元素化合价变化计算转移电子.
| m |
| M |
(2)根据n=
| m |
| M |
(3)根据n=cV计算硫酸铝的物质的量,硫酸根物质的量为硫酸铝的物质的量,根据N=nNA计算硫酸根数目;
(4)所含元素化合价升高的反应物是还原剂;根据n=
| V |
| Vm |
解答:
解:(1)二氧化碳的物质的量为
=0.5mol,标况下二氧化碳的体积为0.5mol×22.4L/mol=11.2L,氮气的质量为0.5mol×28g/mol=14g,
故答案为:11.2;14;
(2)根据n=
可知,等质量的CO和CO2的物质的量之比为44g/mol:28g/mol=11:7,故答案为:11:7;
(3)硫酸铝的物质的量为0.1L×1mol/L=0.1mol,硫酸根物质的量为硫酸铝的物质的量,硫酸根的数目为0.1mol×3×NAmol-1=0.3NA,故答案为:0.3NA;
(4)反应中只有O元素化合价由H2O2中-1价升高为O2中0价,故H2O2是还原剂,反应生成氧气的物质的量为
=0.15mol,故转移电子为0.15mol×2=0.3mol,故答案为:H2O2;0.3.
| 22g |
| 44g/mol |
故答案为:11.2;14;
(2)根据n=
| m |
| M |
(3)硫酸铝的物质的量为0.1L×1mol/L=0.1mol,硫酸根物质的量为硫酸铝的物质的量,硫酸根的数目为0.1mol×3×NAmol-1=0.3NA,故答案为:0.3NA;
(4)反应中只有O元素化合价由H2O2中-1价升高为O2中0价,故H2O2是还原剂,反应生成氧气的物质的量为
| 3.36L |
| 22.4L/mol |
点评:本题考查物质的量有关计算、氧化还原反应计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列说法正确的是( )
| A、乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、油脂的水解反应,都是皂化反应 |
| D、蔗糖是高分子化合物,其水解产物能发生银镜反应 |
己烯雌酚是一种激素类药物,结构如图,下列有关它的叙述中错误的是( )


| A、己烯雌酚可以用有机溶剂萃取 |
| B、己烯雌酚与NaOH溶液和NaHCO3溶液都能反应 |
| C、1 mol己烯雌酚与溴水反应,可消耗5 mol Br2 |
| D、己烯雌酚分子中最多有16个碳原子共平面 |
下列材料不属于铁合金的是( )
| A、塑钢门窗 | B、不锈钢餐具 |
| C、钢化玻璃 | D、汽车底架 |
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、0.1mol?L-1Mg(NO3)2溶液中含有0.2nA个NO3- |
| B、8g CH4中含有10nA个电子 |
| C、常温常压下,22.4L O3中含有3nA个氧原子 |
| D、28g C2H4中含有2nA个碳原子 |
下列说法正确的是( )
| A、甲烷的燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、NaOH(aq)+CH3COOH (aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol (中和热) |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、2H2 (g)+O2(g)=2H2O(l)△H=-571.6kJ/mol (燃烧热) |
下列物质属于纯净物的是( )
| A、漂白粉 | B、盐酸 | C、氯水 | D、液溴 |
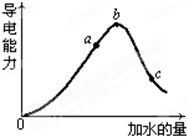 (1)a、b、c三点中醋酸的电离程度最大的是
(1)a、b、c三点中醋酸的电离程度最大的是