题目内容
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、0.1mol?L-1Mg(NO3)2溶液中含有0.2nA个NO3- |
| B、8g CH4中含有10nA个电子 |
| C、常温常压下,22.4L O3中含有3nA个氧原子 |
| D、28g C2H4中含有2nA个碳原子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、溶液体积不明确;
B、求出甲烷的物质的量n=
,根据1mol甲烷含10mol电子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出乙烯的物质的量n=
,根据1mol乙烯含2mol碳原子来分析.
B、求出甲烷的物质的量n=
| m |
| M |
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出乙烯的物质的量n=
| m |
| M |
解答:
解:A、溶液体积不明确,无法计算溶液中NO3-的个数,故A错误;
B、甲烷的物质的量n=
=
=0.5mol,而1mol甲烷含10mol电子,故0.5mol甲烷含5nA个电子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L臭氧的物质的量小于1mol,含有的氧原子的物质的量小于3nA个,故C错误;
D、乙烯的物质的量n=
=
=1mol,而1mol乙烯含2mol碳原子,故含有的碳原子的物质的量为2mol,个数为2nA,故D正确.
故选D.
B、甲烷的物质的量n=
| m |
| M |
| 8g |
| 16g/mol |
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L臭氧的物质的量小于1mol,含有的氧原子的物质的量小于3nA个,故C错误;
D、乙烯的物质的量n=
| m |
| M |
| 28g |
| 28g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
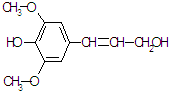 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )| A、芥子醇的分子式是C11H16O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、芥子醇能与3mol溴水反应 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
图(1)废电池需要集中处理,主要原因是电池中含有的( )元素掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤.
| A、Al | B、Ag | C、Hg | D、Na |
下列反应中生成物总能量高于反应物总能量的是( )
| A、氯酸钾受热分解 |
| B、乙醇燃烧 |
| C、铝粉与氧化铁粉末发生铝热反应 |
| D、盐酸与氢氧化钠溶液混合 |
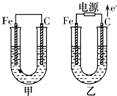 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.