题目内容
1)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
2)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的十倍,可连续使用1个月才充电一次.假设放电过程中甲醇完全氧化产生的CO2被充分吸收生成CO32-.
(1)甲醇在 极发生反应,其电极反应式是 ,正极的电极反应式是
(2)该电池总反应的离子方程式是 .
2)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的十倍,可连续使用1个月才充电一次.假设放电过程中甲醇完全氧化产生的CO2被充分吸收生成CO32-.
(1)甲醇在
(2)该电池总反应的离子方程式是
考点:化学电源新型电池,热化学方程式
专题:电化学专题
分析:1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
2)(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,负极是甲醇发生失电子的氧化反应;
(2)放电时负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,正极电极反应式:O2+2H2O+4e-=4OH-,电池反应为2CH3OH+3O2+4OH-=2CO32-+6H2O;
2)(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,负极是甲醇发生失电子的氧化反应;
(2)放电时负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,正极电极反应式:O2+2H2O+4e-=4OH-,电池反应为2CH3OH+3O2+4OH-=2CO32-+6H2O;
解答:
解:1)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1;
2)(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,即O2+4e-+2H2O=4OH-,负极是甲醇发生失电子的氧化反应,即CH3OH-6e-+8OH-=6H2O+CO32-,
故答案为:负;CH3OH-6e-+8OH-=6H2O+CO32-;O2+4e-+2H2O=4OH-;
(2)放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-,则反应的总方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1;
2)(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,即O2+4e-+2H2O=4OH-,负极是甲醇发生失电子的氧化反应,即CH3OH-6e-+8OH-=6H2O+CO32-,
故答案为:负;CH3OH-6e-+8OH-=6H2O+CO32-;O2+4e-+2H2O=4OH-;
(2)放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-,则反应的总方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
点评:本题主要考查了热化学方程式的书写、原电池的工作原理,题目难度中等,需要注意热化学方程式的书写:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,注意根据题给信息正确书写电极方程式为解答该题的关键.

练习册系列答案
相关题目
充分燃烧一定量丁烷时放出的热量xQ,完全吸收它生成的CO2生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热为( )
| A、16xQ | B、8xQ |
| C、4xQ | D、2xQ |
下列装置图及有关说法正确的是( )
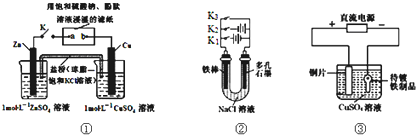

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
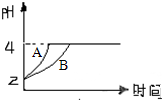 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈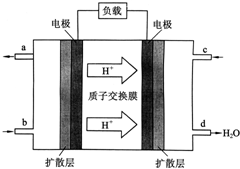 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.