题目内容
7.X、Y、Z、W是原子序数依次增大的短周期主族元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )| A. | W在元素周期表中位于第三周期第IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的常见离子化合物,其阳离子与阴离子个数比可能为1:1 |
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素.已知X原子的最外层电子数是其所在周期数的2倍,为第二周期第ⅣA族或第三周期ⅥA元素,且X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,可在Y为O,Z为Na,X为C;W与Y同主族,W为S,然后结合元素周期律及元素化合物知识解答.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素.已知X原子的最外层电子数是其所在周期数的2倍,为第二周期第ⅣA族或第三周期ⅥA元素,且X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,可在Y为O,Z为Na,X为C;W与Y同主族,W为S,
A.W为S,在元素周期表中位于第三周期第ⅥA族,故A错误;
B.非金属性O>C,X的最简单气态氢化物的热稳定性比Y的弱,故B错误;
C.由X、Y、Z三种元素组成的物质为碳酸钠或碳酸氢钠,水解导致水溶液一定呈碱性,故C正确;
D.由Y、Z两种元素组成的常见离子化合物为Na2O或Na2O2,其阳离子与阴离子个数比均为2:1,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置、元素化合物推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.在一定条件下发生反应:A(g)+B(g)?xC(g)+D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
18.下列四种离子与Ne具有相同的电子层结构的是( )
| A. | Na+ | B. | Cl- | C. | ca2+ | D. | S2- |
2.硫磺在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,乙溶液褪色变成丙.甲、乙、丙均含有硫元素,则它们正确的顺序是( )
| A. | SO3、H2SO4、H2SO3 | B. | SO2、H2SO3、H2SO4 | C. | SO3、H2SO3、H2SO4 | D. | SO2、H2SO4、H2SO3 |
12.下列物质属于纯净物的是( )
| A. | 寒冷的干冰 | B. | 清清的海水 | C. | 清新的空气 | D. | 坚硬的大理石 |
19.化学用语书写正确的是( )
| A. | NaHS水解反应:HS-+H2O═H3O++S2- | |
| B. | 1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | |
| C. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入碳酸氢钠:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
16.根据热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.23kJ/mol.下列说法中正确的是( )
| A. | S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol | |
| B. | S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol | |
| C. | 1mol SO2的键能总和小于1mol S和1mol O2键能之和 | |
| D. | 1mol SO2的具有的能量等于1mol S和1mol O2具有的能量之和 |
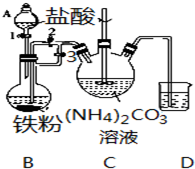 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.