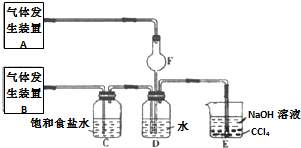
题目内容
2.硫磺在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,乙溶液褪色变成丙.甲、乙、丙均含有硫元素,则它们正确的顺序是( )| A. | SO3、H2SO4、H2SO3 | B. | SO2、H2SO3、H2SO4 | C. | SO3、H2SO3、H2SO4 | D. | SO2、H2SO4、H2SO3 |
分析 硫黄在空气中燃烧生成气体甲为SO2,与水反应生成H2SO3,能被溴水氧化生成H2SO4,以此解答.
解答 解:硫磺在空气中燃烧生成气体二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
二氧化硫溶于水得亚硫酸溶液,SO2+H2O=H2SO3;
向亚硫酸溶液中滴加溴水生成硫酸,H2O+H2SO3+Br2═2HBr+H2SO4;
则甲、乙、丙依次为SO2、H2SO3、H2SO4;
故选B.
点评 本题考查含硫化合物的综合运用,侧重于元素化合物知识的考查,题目难度不大,注意S在空气中燃烧产物是二氧化硫不是三氧化硫.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
12.下列参数比较及解释均正确的是( )
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
13. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
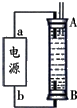
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
17.把1gNaOH溶于水配制成50mL溶液,所得溶液中NaOH的物质的量浓度为( )
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
7.X、Y、Z、W是原子序数依次增大的短周期主族元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )
| A. | W在元素周期表中位于第三周期第IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的常见离子化合物,其阳离子与阴离子个数比可能为1:1 |
14.下列仪器可以用酒精灯直接加热的是( )
| A. | 试管,烧杯 | B. | 烧瓶,烧杯 | C. | 试管,蒸发皿 | D. | 蒸发皿,量筒 |
11.补血保健品含有Fe2+的物质,但同时也加入维生素C,加入维生素C是利用了它的( )
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |