题目内容
8.已知酸、碱、盐和金属氧化物都是电解质,下列物质中不属于电解质的是( )| A. | 氢氧化钠 | B. | 氧化钾 | C. | 硫酸钡 | D. | 二氧化硫 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等,据此解答即可.
解答 解:A、氢氧化钠为碱,属于电解质,故A错误;
B、氧化钾为金属氧化物,熔融状态下能电离,属于电解质,故B错误;
C、硫酸钡属于盐,熔融状态下能电离,属于电解质;
D、二氧化硫不能电离,其水溶液导电的原因是二氧化硫与水反应生成亚硫酸,亚硫酸电离出自由移动的离子导电,故二氧化硫属于非电解质,故D正确,故选D.
点评 本题主要考查的是电解质与非电解质的概念,难度不大,掌握电解质与非电解质均属于化合物是解决本题的关键.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
18.已知同周期两种非金属元素X、Y,电负性X>Y,下列说法错误的是( )
| A. | 含氧酸的酸性:X对应的强于Y对应的 | |
| B. | 气态氢化物的稳定性:HmX强于HnY | |
| C. | 第一电离能可能Y大于X | |
| D. | X与Y形成化合物时,X显负价,Y显正价 |
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H1=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g);△H2=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热△H=-192.9 kJ•mol-1 | |
| B. |  ②中的能量变化如图所示,则△H2=E1-E3 ②中的能量变化如图所示,则△H2=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
3.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. |  给液体加热 | B. | 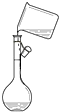 转移溶液 | C. | 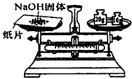 称取NaOH固体 | D. | 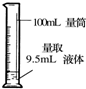 量取液体 |
17.下列关于浓HNO3和浓H2SO4的叙述中不正确的是( )
| A. | 常温下二者都可用铁制容器贮存 | B. | 常温下二者都能与铜较快反应 | ||
| C. | 露置于空气中,溶液浓度均降低 | D. | 浓HNO3与浓H2SO4都具有强氧化性 |
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
