题目内容
18.已知同周期两种非金属元素X、Y,电负性X>Y,下列说法错误的是( )| A. | 含氧酸的酸性:X对应的强于Y对应的 | |
| B. | 气态氢化物的稳定性:HmX强于HnY | |
| C. | 第一电离能可能Y大于X | |
| D. | X与Y形成化合物时,X显负价,Y显正价 |
分析 同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y.
A.非金属性越强,最高价含氧酸的酸性越强,不是最高价含氧酸则不一定;
B.非金属性越强,氢化物越稳定;
C.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能;
D.电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大.
解答 解:同周期元素,自左而右元素的电负性增强,电负性X>Y,故原子序数X>Y.
A.非金属性越强,最高价含氧酸的酸性越强,不是最高价含氧酸则不一定,若非金属性Cl>S,但HClO为弱酸,而硫酸为强酸,故A错误;
B.非金属性越强,最高价含氧酸的酸性越强,同周期自左而右元素的非金属性增强,故非金属性X>Y,所以氢化物的稳定性:HmX强于HnY,故B正确;
C.若Y的第一电离能失去的电子所处能级为半满稳定状态,其第一电离能可能高于X的第一电离能,如第一电离能P>S,故C正确;
D、电负性表示原子对键合电子吸引的大小,电负性越大的原子,对键合电子的吸引力越大,电负性X>Y,键合电子偏向X原子,偏离Y原子,故X与Y形成化合物中,X显负价,Y显正价,故D正确;
故选B.
点评 本题考查同周期元素性质递变规律、电离能、电负性等,难度不大,注意同周期元素中第一电离能异常情况.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某有机物结构简式如下: 它的名称为( )
它的名称为( )
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
9.如图装置或操作不合理或不能达到实验目的是( )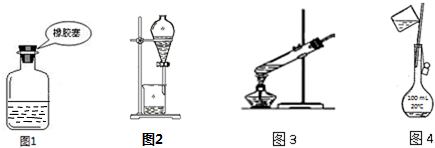

| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
6.铅的冶炼、加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH 变化的关系如图所示:
(1)往含Pb2+的溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+,pH=9时,主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是Fe3+.
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+.则脱铅的最合适pH 范围为B(填字母).
A.4~5B.6~7C.9~10D.11~12.

(1)往含Pb2+的溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+,pH=9时,主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+.则脱铅的最合适pH 范围为B(填字母).
A.4~5B.6~7C.9~10D.11~12.
10.已知C-C键可以绕键轴自由旋转,结构简式为 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
7.如图是元素周期表的一部分,针对表中的①-⑩中元素,填写下列空格:
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是钠(填元素名称),最活泼的非金属单质是F2(化学式),元素④对应的离子结构示意图为 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;
(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
8.已知酸、碱、盐和金属氧化物都是电解质,下列物质中不属于电解质的是( )
| A. | 氢氧化钠 | B. | 氧化钾 | C. | 硫酸钡 | D. | 二氧化硫 |


 或
或 .
.