题目内容
19. 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.请回答下列问题:
(1)A元素的名称是氢;
(2)B的元素符号是F,C的元素符号是Cl,
(3)E属元素周期表中第四周期,第VIIB族的元素,其元素名称是锰,它的+2价离子的电子排布式为1s22s22p63s23p63d5.
(4)从图中可以看出,D跟B形成的离子化合物的化学式为CaF2;该离子化合物晶体的密度为a g•cm-3,则晶胞的体积是$\frac{4×78g/mol}{ag.c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$ (只要求列出算式).
分析 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;E是周期表中1-18 列中的第7列元素,可判断E是第4周期VIIB族的Mn元素,原子序数为25,D的原子序数比E小5,则D的原子序数为20,故D为Ca元素;D跟B可形成离化合物,其晶胞中D与B的离子个数比值为:(8×$\frac{1}{8}$+6×$\frac{1}{2}$):8=1:2,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的原子序数较小,则B为F,C为Cl,D跟B形成的离子化合物为CaF2,计算晶胞质量,根据V=$\frac{m}{ρ}$计算晶胞体积.
解答 解:A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;E是周期表中1-18 列中的第7列元素,可判断E是第4周期VIIB族的Mn元素,原子序数为25,D的原子序数比E小5,则D的原子序数为20,故D为Ca元素;D跟B可形成离化合物,其晶胞中D与B的离子个数比值为:(8×$\frac{1}{8}$+6×$\frac{1}{2}$):8=1:2,则B的化合价为-1价,应为第ⅦA族元素,B和C属同一主族,B的原子序数较小,则B为F,C为Cl.
(1)A为H元素,名称为氢,故答案为:氢;
(2)B为F元素,C为Cl元素,故答案为:F;Cl;
(3)E为Mn元素,位于周期表第四周期第七列,则应位于VIIB族,原子的核外电子的排布式为1s22s22p63s23p63d54s2,+2价离子的电子排布式为1s22s22p63s23p63d5,
故答案为:四;VIIB; 锰; 1s22s22p63s23p63d5;
(4)从图中可以看出,晶胞中含有Ca的离子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有F的离子个数为8,二者比值为1:2,则化学式为CaF2,晶胞V=$\frac{\frac{78g/mol}{6.02×1{0}^{23}mo{l}^{-1}}×4}{ag.c{m}^{-3}}$=$\frac{4×78g/mol}{ag.c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$,
故答案为:CaF2;$\frac{4×78g/mol}{ag.c{m}^{-3}×6.02×1{0}^{23}mo{l}^{-1}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、晶胞计算等,推断元素是解题关键,注意利用均摊法进行晶胞有关计算,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案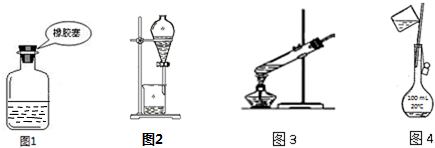
| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
| A. | 镁在空气中和纯净氧气中的燃烧产物只有MgO | |
| B. | 硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3 | |
| C. | 钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2 | |
| D. | 浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小 |

(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 | O2 | CO2 | HCl |
| 试剂 |
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 | 该装置中反应的离子方程式 |
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
| A. | 氢氧化钠 | B. | 氧化钾 | C. | 硫酸钡 | D. | 二氧化硫 |
