题目内容
3.下列各图与表述一致的是( )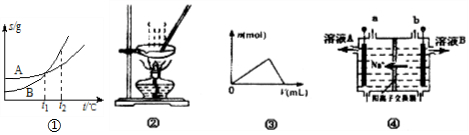
| A. | 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| B. | 用图②所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
分析 A.将t1℃时A、B饱和溶液分别升温至t2℃时,溶液由饱和变成不饱和,浓度不变;
B.加热FeCl3溶液促进铁离子的水解;
C.向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液,开始时生成氢氧化铝沉淀,当氢氧化钡过量,氢氧化铝溶解;
D.电解饱和食盐水的装置中,阳极上产生氧气,氢氧根离子失电子,阴极上是氢离子浓度减小,生成氢气和氢氧化钠,氢氧化钠抑制水的电离.
解答 解:A.将t1℃时A、B饱和溶液分别升温至t2℃时,溶液由饱和变成不饱和,浓度不变,所以溶质的质量分数B=A,故A错误;
B.加热FeCl3溶液促进铁离子的水解,水解生成氢氧化铁,加热蒸干得到氢氧化铁,得不到无水FeCl3,故B错误;
C.向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液,开始时生成氢氧化铝沉淀,当氢氧化钡过量,氢氧化铝溶解,所以Al(OH)3沉淀的物质的量开始逐渐增大,达到最大值又逐渐减少,最后全部溶解,故C正确;
D.图电解饱和食盐水的装置中,根据钠离子移向阴极,知道b是阳极,该极上产生氯气、氧气,氢氧根离子失电子,a是阴极,该电极上是氢离子浓度减小,生成氢气和氢氧化钠,溶液A、B中由水电离出的c(H+):A<B,故D错误.
故选C.
点评 本题考查较为综合,涉及盐类水解、物质间的反应、电解等知识,侧重于学生的分析能量的考查,为高考常见题型,注意相关基础知识的学习,难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
7.硝酸铵溶液中,离子浓度由大到小的顺序是( )
| A. | c(NH4+)>c(NO3-)>c(H+)>c(OH-) | B. | c(NO3-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(NH4+)>c(NO3-)>c(OH-) | D. | c(OH-)>c(NO3-)>c(NH4+)>c(H+) |
14.下列指定反应的离子方程式正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 银氨溶液中滴加过量的盐酸:Ag(NH3)2++2H+═Ag++2NH4+ | |
| C. | 过量的铁粉与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
11.下列化学式能真实表示物质分子组成的是( )
| A. | KC1 | B. | SiO2 | C. | SO3 | D. | NaOH |
18.用下列实验方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaC1 | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 证明HClO 和CH3COOH的酸性强弱 | 同温下,用pH试纸定浓度均为0.1mol•L-1的NaClO溶液和CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中水加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1L1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4•5H2O溶解在975g水中 | 烧杯、玻璃棒、胶头滴管、量筒 |
| A. | A | B. | B | C. | C | D. | D |
8.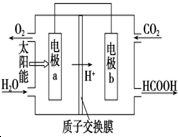 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJ•mol-1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=a+bkJ•mol-1.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.032 mol•L-1•min-1,T1℃时,该反应的平衡常数K=0.25.
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”、“<”或“═”)
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJ•mol-1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=a+bkJ•mol-1.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”、“<”或“═”)
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是cd (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=1.25mol/L.NO的转化率不变(填“增大”、“减小”或“不变”).
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为CO2+2H++2e-=HCOOH.
2.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数.下列说法正确的是( )
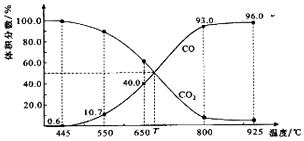

| A. | 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
14.关于分枝酸(如图)的说法正确的是( )


| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |