题目内容
7.硝酸铵溶液中,离子浓度由大到小的顺序是( )| A. | c(NH4+)>c(NO3-)>c(H+)>c(OH-) | B. | c(NO3-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(NH4+)>c(NO3-)>c(OH-) | D. | c(OH-)>c(NO3-)>c(NH4+)>c(H+) |
分析 硝酸铵是强酸弱碱盐,弱离子铵根离子水解,硝酸根离子是强离子,而且溶液水解呈酸性,氢离子的浓度大于氢氧根离子的浓度,由此分析解答.
解答 解:硝酸铵是强酸弱碱盐,弱离子铵根离子水解,硝酸根离子是强离子,而且溶液水解呈酸性,氢离子的浓度大于氢氧根离子的浓度,所以离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),故选B.
点评 本题以离子浓度大小比较为载体考查盐类水解,为高频考点,明确盐类型及盐类水解特点是解本题关键,注意硝酸铵是强酸弱碱盐,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 沸点:水>碲化氢>硒化氢 | |
| D. | 晶格能由大到小:MgO>CaO>NaF>NaCl |
15.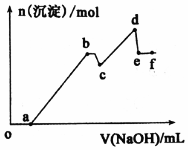 已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
 已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )| A. | b 点沉淀-Al(OH)3;d 点沉淀-A1(OH)3和Mg(OH)2;e点溶质-NaA1O2 | |
| B. | 依据题意,用NaOH不能完全分离Mg2+和Al3+离子 | |
| C. | cd 段发生的反应为:Mg2++2OH-=Mg(OH)2↓ | |
| D. | bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O |
12.下列实验现象的描述中不正确的是( )
| A. | 铁丝在空气中燃烧,火星四射,产生红棕色的烟 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 在试管中加热铜绿有黑色固体生成 | |
| D. | 人造丝在酒精灯的火焰上灼烧会产生烧焦羽毛的气味 |
3.下列各图与表述一致的是( )
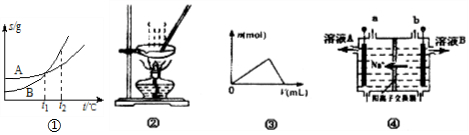

| A. | 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| B. | 用图②所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
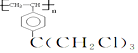 .
.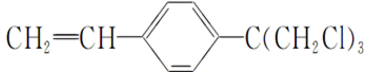

 +R3
+R3 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$ +R2OH
+R2OH .
. .
.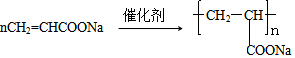 .
. .
.