题目内容
8.关于氧化还原反应的说法正确的是( )| A. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | H2O既有氧化性又有还原性 | |
| D. | KMnO4是一种强氧化剂,没有还原性 |
分析 判断物质是否有氧化性,可根据元素化合价的变化判断,如元素化合价升高,则被氧化,表现还原性,如降低,被还原,表现氧化性,以此解答该题.
解答 解:A.氧化还原反应不一定有单质参加,如SO2+Cl2+2H2O=H2SO4+2HCl,故A错误;
B.如非金属性单质元素化合价处于中间价态,则既具有氧化性也具有还原性,故B错误;
C.H2O中H元素化合价为+1价,为最高价态,O为-2价,为最低价态,则既有氧化性又有还原性,故C正确;
D.KMnO4是一种强氧化剂,O元素为-2价,具有还原性,可自身发生氧化还原反应生成氧气,故D错误.
故选C.
点评 本题考查氧化剂、还原剂及氧化还原反应,侧重考查基本概念的考查,明确元素化合价变化即可解答,熟练掌握常见元素化合价,题目难度不大.

练习册系列答案
相关题目
7.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7 |
19.水的摩尔质量是( )
| A. | 18 | B. | 18mol | C. | 18 g | D. | 18g/mol |
16.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
3. “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为 2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
①实验1中以v(CO2)表示的反应速率为0.13mol/(L•min)(保留二位小数,下同).
②实验2条件下平衡常数K=0.17,该反应为放(填“吸”或“放”)热反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l))△H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
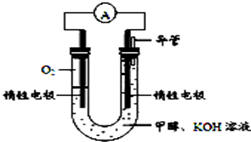
(4)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置.
①该电池正极的电极反应为O2+H2O+4e-=4OH-.
②该电池工作时,溶液中的OH-向负极移动.
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为 2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=0.17,该反应为放(填“吸”或“放”)热反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l))△H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(4)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置.
①该电池正极的电极反应为O2+H2O+4e-=4OH-.
②该电池工作时,溶液中的OH-向负极移动.
20.用NA表示阿伏加德罗常数值.下列叙述正确的是( )
| A. | 64g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 0.5NA个O2的质量为32g | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
17.下列反应中的氨与反应4NH3+5O2═4NO+6H2O中的氨作用相同的是( )
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | NH3+HNO3═NH4NO3 | D. | 3SiH4+4NH3═Si3N4+12H2 |
