题目内容
3. “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为 2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=0.17,该反应为放(填“吸”或“放”)热反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol
③H2O(g)=H2O(l))△H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
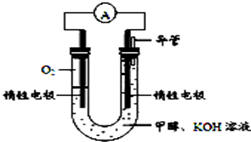
(4)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置.
①该电池正极的电极反应为O2+H2O+4e-=4OH-.
②该电池工作时,溶液中的OH-向负极移动.
分析 (1)分析方程式中各元素化合价变化,根据氧化还原反应中得失电子数相等和原子守恒来配平化学方程式;(2)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=$\frac{\frac{△V}{V}}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(4)①燃料电池正极氧气碱性环境下得到电子生成氢氧根离子;
②原电池,阴离子移向负极.
解答 解:(1)高锰酸钾中锰元素化合价降低7-2=5价,碳元素化合价升高4-0=4价,化合价升高数=化合价降低数,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,反应的化学方程式为:5 C+4KMnO4+6 H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O;
故答案为:5,4,6,5,4,2,6;
(2)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=$\frac{\frac{1.6mol}{2L}}{6min}$=0.13mol/(L•min),依据速率之比等于化学计量数之比,则v(CO2)=v(CO)=0.13mol/(L•min);
故答案为:0.13mol/(L•min);
②H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{c(C{O}_{2})c({H}_{2})}{c({H}_{2}O)c(CO)}$=$\frac{0.2×0.2}{0.3×0.8}$=0.17;
实验1中CO的转化率为$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{0.4mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
故答案为:0.17;放;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
得到热化学方程式为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)①燃料电池正极氧气碱性环境下得到电子生成氢氧根离子,电极反应式为:O2+H2O+4e-=4OH-;
故答案为:O2+H2O+4e-=4OH-;
②氢氧根离子为阴离子,原电池中阴离子移向负极,故答案为:负.
点评 本题为综合题,考查了氧化还原反应方程式配平,化学平衡的影响因素分析判断,平衡常数计算应用,盖斯定律的计算应用,原电池电极反应的书写方法,题目难度中等,注意用三段式进行有关化学平衡计算的方法.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2
②混入KI溶液中的KHCO3可滴加盐酸除去
③碘升华形成的污迹可用热的浓盐酸洗去
④制Cl2后的黑褐色污迹可用热的浓盐酸洗去.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
| A. | 氯气溶于水:Cl2+H2O═2H ++Cl -+ClO - | |
| B. | Na2CO3溶液中CO32的水解:CO32-+H2O═HCO32-+OH - | |
| C. | 酸性溶液中KIO3与KI反应生成I 2:IO3-+I -+6H +═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO32-+Ba2++OH -═BaCO3↓+H 2O |
| A. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | H2O既有氧化性又有还原性 | |
| D. | KMnO4是一种强氧化剂,没有还原性 |
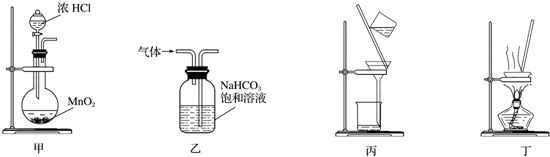
| A. | 用甲装置制取氯气 | B. | 用乙装置除去Cl2中的少量氯化氢 | ||
| C. | 粗盐的提纯过程中用到丙装置 | D. | 用丁装置蒸干溶液制取NH4HCO3 |

(1)如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生氧化反应(填写“氧化”或“还原”),写出正极的电极反应式O2+4H++4e-=2H2O;
(2)如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入NH4Cl固体中,过一会取出,发现插入部分的黑色变为光亮的红色,查阅资料可知,该过程有N2生成,写出由黑色变为光亮红色过程的反应方程式2NH4Cl+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II 在一个密闭容器中发生反应:mA(g)+nB(g)?pC(g)
(1)该反应未加催化剂的v-t图象如图丙,若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图丁所示.以下说法正确的是②③⑤ (填序号)
①a1>a2
②b1<b2
③t1>t2
④右图中阴影部分面积更大
⑤两图中阴影部分面积相等
(2)在一定温度和不同压强下达到平衡时,分别得到物质A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从2×105加压到5×105时,平衡的移动方向是C.
A.朝正反应方向移动 B.朝逆反应方向移动 C.不移动 D.不能确定
③其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图2,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题: