题目内容
4.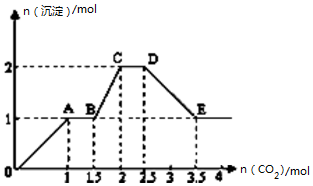 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
分析 通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+,根据离子共存条件,一定不含SO42-,因二者反应会生成硫酸钡沉淀;在BC段产生沉淀,说明含AlO2-,AlO2-存在碱性环境,故一定含OH-,不含NH4+,因NH4+与OH-反应放氨气,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以 Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含 OH-共2.5mol,根据BC段可知发生反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应:CO32-+CO2+H2O═2HCO3-,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带:2mol,阴离子所带负电荷为AlO2-、OH-所带:2.5mol+1mol=3.5mol,故一定还含阳离子,根据电荷守恒,计算出所含阳离子物质的量,进而计算出浓度.
解答 解:通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+,根据离子共存条件,一定不含SO42-,因二者反应会生成硫酸钡沉淀;在BC段产生沉淀,说明含AlO2-,AlO2-存在碱性环境,故一定含OH-,不含NH4+,因NH4+与OH-反应放氨气,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以 Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含 OH-共2.5mol,根据BC段可知发生反应:2AlO2-+CO2+3H2O═2A l(OH)3↓+CO32-,故消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应:CO32-+CO2+H2O═2HCO3-,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带:2mol,阴离子所带负电荷为AlO2-、OH-所带:2.5mol+1mol=3.5mol,故一定还含阳离子.
A.根据以上分析,该溶液中能确定存在的离子是Ba2+、AlO2-、OH-,故A错误;
B..根据以上分析,该溶液中一定不含:NH4+、Cl-、SO42-,故B错误;
C.不能确定离子中至少还存在一种阳离子存在,所给阳离子中还有K+、Na+没确定,可通过焰色反应来鉴别;根据电荷守恒,所含离子的物质的量设为n,则有:n+2mol=4mol,n=2,浓度为:$\frac{2.0mol}{10L}$=0.20mol/L,故C正确;
D.BC段反应的离子方程式:2AlO2-+CO2+3H2O═2A l(OH)3↓+CO32-,故D错误;
故选C.
点评 本题考查了离子的推断,难度较大,关键是搞清反应原理结合离子共存和电荷守恒解答.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
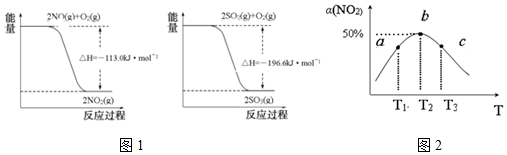
(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.
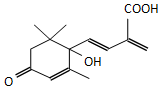 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )| A. | 其分子式为C14H20O4 | |
| B. | 该物质中含有3种含氧官能团 | |
| C. | 既能发生加成反应,又能发生取代反应 | |
| D. | 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色 |
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
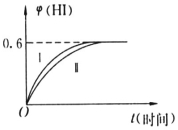 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ). 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题: