题目内容
14.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表所示:| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
(2)反应达到平衡时,Y的转化率为75%.
(3)此反应的平衡常数表达式为K=59.26(mol/L)-2.
分析 由表格中X、Y的浓度减小,Z的浓度增大,X、Y、Z的浓度变化量之比(0.1-0.05):(0.2-0.05):(0.1-0)=1:3:2,可知反应为X+3Y?2Z,结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%、K为生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:(1)已知反应2min达到平衡,则v(X)=$\frac{0.1mol/L-0.05mol/L}{2min}$=0.025mol/(L•min),故答案为:0.025;
(2)反应达到平衡时,Y的转化率为$\frac{0.2mol-0.05mol}{0.2mol}$×100%=75%,故答案为:75%;
(3)由表格中X、Y的浓度减小,Z的浓度增大,X、Y、Z的浓度变化量之比(0.1-0.05):(0.2-0.05):(0.1-0)=1:3:2,可知反应为X+3Y?2Z,结合平衡浓度可知此反应的平衡常数表达式为K=$\frac{0.{1}^{2}}{0.05×0.1{5}^{3}}$=59.26(mol/L)-2,故答案为:59.26(mol/L)-2.
点评 本题考查化学平衡的计算,为高频考点,把握化学反应方程式的确定、平衡常数及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列过程中,既有离子键被破坏,又有共价键被破坏的是( )
| A. | 溴蒸汽被木炭吸附 | B. | 烧碱熔化 | ||
| C. | 碳酸钙高温分解 | D. | HCl溶于水 |
2.下列装置或操作(有的夹持装置已省略)正确且能达到目的是( )
| A. | 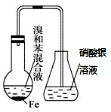 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 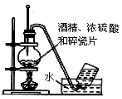 实验室制备并收集乙烯 | |
| C. | 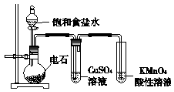 制备乙炔并检验其性质 | |
| D. | 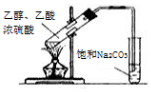 乙醇与乙酸反应制备乙酸乙酯 |
9.下列各组离子在指定溶液中能大量共存的是( )
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、NO3-、AlO2- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
19.欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 苯(苯酚):加入浓溴水,过滤 | |
| C. | 乙醇(水):加入金属钠,蒸馏 | |
| D. | 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气 |
6.N2+3H2$?_{高温高压}^{催化剂}$2NH3是工业上制造氮肥的重要反应.下列有关说法正确的是( )
| A. | 降低N2的浓度能加快反应速率 | |
| B. | 降低体系温度能加快反应速率 | |
| C. | 达平衡时各组分含量之比一定等于 1:3:2 | |
| D. | 达到平衡时N2的浓度不再变化 |
3.下列关于物质的性质与应用具有对应关系的是( )
| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 | |
| D. | 氢氧化铝具有弱性,可用于制胃酸中和剂 |
4.已知反应:?Cl2+2KBr=2KCl+Br2②KClO3+6HCl=3Cl2↑+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是( )
| A. | 上述三个反应都是置换反应 | |
| B. | 反应②中还原剂与氧化剂的物质的量之比为6:1 ①中KCl是氧化产物,KBr发生还原反应 | |
| C. | 氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2 | |
| D. | 反应③中1molKBrO3反应,则还原剂得电子的物质的量为5 mol |