题目内容
9.下列各组离子在指定溶液中能大量共存的是( )| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、NO3-、AlO2- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
分析 A.能使红色石蕊试纸变蓝的溶液,显碱性;
B.离子之间结合生成络离子;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液;
D.能使湿润的淀粉碘化钾试纸变蓝的溶液,具有氧化性.
解答 解:A.能使红色石蕊试纸变蓝的溶液,显碱性,该组离子之间不反应,可大量共存,故A选;
B.SCN-、Fe3+结合生成络离子,不能共存,故B不选;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Fe2+、NH4+,酸溶液中Al或Fe2+与NO3-发生氧化还原反应不生成氢气,故C不选;
D.能使湿润的淀粉碘化钾试纸变蓝的溶液,具有氧化性,与S2-发生氧化还原反应不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数的数值,则下列叙述正确的是( )
| A. | 1 mol HCl气体所含H+数目为NA | |
| B. | 1 mol CO2气体含有的C═O键数为NA | |
| C. | 4.6 g分子式为C2H6O的有机物,所含C-H键数目一定为0.5NA | |
| D. | 1 mol Na2O2所含的阴阳离子总数为3NA |
20.鉴别Cl-、Br-、I-可以选用的试剂是( )
| A. | 溴化钠溶液与四氯化碳 | B. | 碘化钾淀粉溶液 | ||
| C. | 氯水、四氯化碳 | D. | 碘水、淀粉溶液 |
17.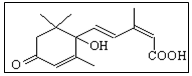 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H18O4 | |
| B. | 分子中存在4种含氧官能团 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 1mol该有机物最多可与4molBr2发生加成反应 |
4. 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( )| A. | △H<0 | B. | 从Y点到Z点可通过升高温度实现 | ||
| C. | 从Y点到X点可通过使用催化剂实现 | D. | 600 K时,Y点甲醇的v正<v逆 |
14.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表所示:
(1)已知反应2min达到平衡,则v(X)=0.025mol/(L•min).
(2)反应达到平衡时,Y的转化率为75%.
(3)此反应的平衡常数表达式为K=59.26(mol/L)-2.
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
(2)反应达到平衡时,Y的转化率为75%.
(3)此反应的平衡常数表达式为K=59.26(mol/L)-2.
1. 已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )
已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )
 已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )
已知:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电路中每通过4 mol电子,电池内部释放632 kJ热能 | |
| D. | 每34 g H2S参与反应,有2 mol H+经质子膜进入正极区 |
18.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | CO2$\stackrel{H_{2}O}{→}$H2CO3$\stackrel{BaCl_{2}(aq)}{→}$BaCO3 | B. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | ||
| C. | MgCO3$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{通电}{→}$Mg | D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$FeCl2(aq) |
19.已知反应M(g)+3N(g)?2Z(g)△H<0,在密闭容器中反应达到平衡时,N物质的量浓度为0.6mol/L.下列说法正确的是( )
| A. | N的正反应速率是M的逆反应速率的3倍 | |
| B. | 恒温恒容下,通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 恒温下,扩大容器体积至原来的两倍,则N物质的量浓度大于0.6 mol/L | |
| D. | 恒温恒压下,增加Z的物质的量,重新达平衡时,N物质的量浓度大于0.6 mol/L |