题目内容
6.(1)6.02×1023个CO2在标况下所占的体积约为11.2L;(2)所含氢原子数相等的甲烷(CH4)和氨气(NH3)的质量比为12:17.
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算二氧化碳物质的量,再根据V=nVm计算二氧化碳的体积;
(2)甲烷的分子式为CH4,则含氢原子数相等的甲烷和氨气的物质的量之比为3:4,结合m=nM计算.
解答 解:(1)3.01×1023个CO2分子的物质的量为:$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,则二氧化碳在标准状况下的体积约为:0.5mol×22.4L/mol=11.2L,
故答案为:11.2;
(2)含氢原子数相等时,甲烷(CH4)和氨气(NH3)的物质的量之比为$\frac{1}{4}$:$\frac{1}{3}$=3:4,则二者的质量比为3×16:4×17=12:17,
故答案为:12:17.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题侧重考查学生的化学计算能力.

练习册系列答案
相关题目
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| B. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| C. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- |
17.下列离子方式正确的是( )
| A. | 向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-═2C6H5OH+CO32- | |
| D. | 向40mL0.5mol/LFeBr2溶液中通入448mLCl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.
18.某学生将1-氯乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
15.根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | 氢化物的沸点为H2T<H2R |
16.如图为铜锌原电池示意图,下列说法中不正确的是( )
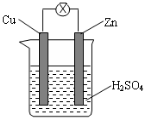

| A. | 锌片逐渐溶解,铜片上有气泡 | B. | 锌片为正极,铜片为负极 | ||
| C. | 电子由锌片通过导线流向铜片 | D. | 该装置能够将化学能转化为电能 |
