题目内容
15.根据表1信息,判断以下叙述正确的是( )表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | 氢化物的沸点为H2T<H2R |
分析 短周期元素中,R和T的化合价都有-2价,处于ⅥA族,R的最高价为+6价,T无正价,且R的原子半径较大,则R为S元素,T为O元素;L和Q的化合价都为+2价,处于ⅡA族,且L的原子半径大于Q的,则Q为Be,L为Mg;M的化合价为+3价,为周期表第ⅢA族元素,而M原子半径大于硫、小于Mg,则M为Al.
A.核外电子数=质子数-离子带的电荷;
B.金属性越强,与酸反应越剧烈;
C.氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水;
D.分子之间形成氢键,增大物质的沸点.
解答 解:短周期元素中,R和T的化合价都有-2价,处于ⅥA族,R的最高价为+6价,T无正价,且R的原子半径较大,则R为S元素,T为O元素;L和Q的化合价都为+2价,处于ⅡA族,且L的原子半径大于Q的,则Q为Be,L为Mg;M的化合价为+3价,为周期表第ⅢA族元素,而M原子半径大于硫、小于Mg,则M为Al.
A.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故A错误;
B.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为Q<L,故B错误;
C..M与T形成的化合物是氧化铝,能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水,氧化铝是两性氧化物,故C正确;
D.水分子之间形成氢键,沸点高于硫化氢的,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,关键是根据原子半径及化合价来推断元素,注意对元素周期律的理解,熟悉元素及其单质、化合物的性质.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
20.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1
I2(g)+H2(g)═2HI(g)△H=-9.4kJ•mol-1.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1
I2(g)+H2(g)═2HI(g)△H=-9.4kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
4.在海水浓缩过程中,析出盐的种类和质量见下表,(单位g/L)
当海水密度达到1.21~1.22g/mL时,析出的盐中,质量分数最大的是( )
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | Mg SO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
| A. | CaSO4 | B. | MgSO4 | C. | NaCl | D. | MgCl2 |
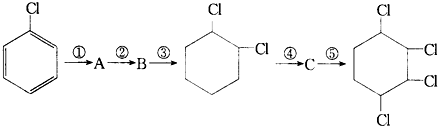
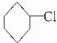 B
B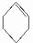
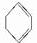 .
.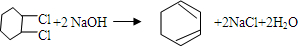 .
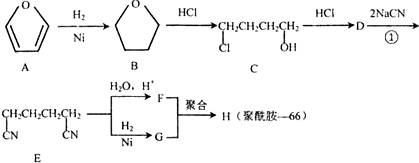
.
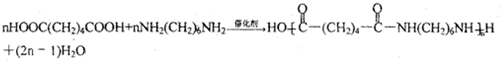 .
.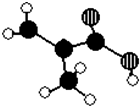 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).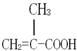 ,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.
,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.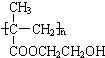 .
.