题目内容
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| B. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| C. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- |
分析 A.离子之间发生氧化还原反应;
B.离子之间结合生成络离子;
C.使甲基橙呈红色的溶液,显酸性;
D.$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液,显碱性.
解答 解:A.H+、Fe2+、H2O2发生氧化还原反应,不能大量共存,故A不选;
B.Fe3+、SCN-结合生成络离子,不能大量共存,故B不选;
C.使甲基橙呈红色的溶液,显酸性,不能大量存在AlO2-、CO32-,故C不选;
D.$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
7.下列各组指定的元素,不能形成AB2型化合物的是( )
| A. | 3s1和3s23p4 | B. | 3s23p4 和2s22p4 | ||
| C. | 3s2和2s22p5 | D. | 2s22p2 和2s22p4 |
4.下列离子方程式书写不正确的是( )
| A. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| B. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| D. | 向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
5.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
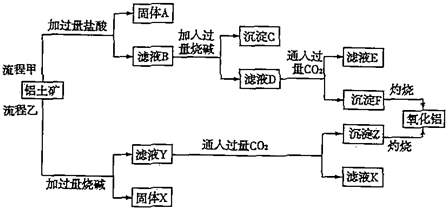
 .
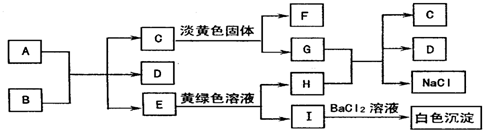
.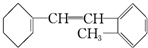 ,据此填写下列空格.
,据此填写下列空格.