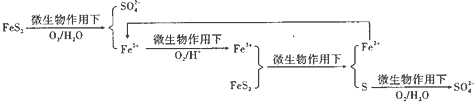
题目内容
16.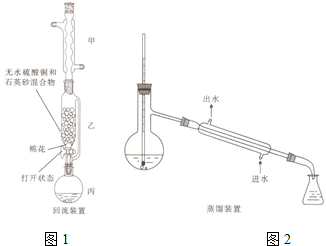 苯甲酸(
苯甲酸(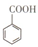 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |
(1)仪器甲的名称为球形冷凝管.
(2)①往丙中加入药品的顺序为C.
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是停止加热,冷却后再加入沸石.
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为蓝色.
(3)加入碳酸钠粉末的作用是中和浓硫酸及未反应的苯甲酸.
(4)分液要用到的玻璃仪器有分液漏斗、烧杯,粗产物在下层(填“上”或“下”).
(5)加热蒸馏若采用2图装置(加热装置已经略去)进行,该装置存在的2个问题为温度计的水银球不应插入反应液中、不应用直型冷凝管.
(6)本实验所得到的苯甲酸乙酯产率为80%.
(7)装置乙的作用为乙中的吸水剂可以吸收反应中产生的水分,有利于提高酯的产率.
分析 (1)由仪器甲的结构可知,仪器甲为球形冷凝管;
(2)①应将液体加热固体中,将浓硫酸注入溶液中,防止溶液飞溅;
②加热反应后发现未加沸石,应停止加热,冷却后再加入沸石;
③反应有水生成,硫酸铜吸水后变为蓝色;
(3)中和浓硫酸及未反应的苯甲酸;
(4)分液要用到的玻璃仪器有分液漏斗、烧杯,苯甲酸乙酯的密度比水大,溶液分层后在下层;
(5)温度计控制馏分温度,水银球应在蒸馏烧瓶支管口处,苯甲酸乙酯沸点高,不应该用直形冷凝管,会由温差过大导致破裂;
(6)计算乙醇的质量,再进行过量计算,根据不足量物质计算苯甲酸乙酯的理论产量,进而计算产率;
(7)及时除去反应中产生的水可提高酯的产率.
解答 解:(1)由仪器甲的结构可知,仪器甲为球形冷凝管,故答案为:球形冷凝管;
(2)①应将液体加热固体中,将浓硫酸注入溶液中,防止溶液飞溅,往丙中加入药品的顺序为:苯甲酸晶体、无水乙醇、浓硫酸,故选:C;
②加入沸石,防止加热时暴沸,加热反应后发现未加沸石,应停止加热,冷却后再加入沸石,
故答案为:停止加热,冷却后再加入沸石;
③反应有水生成,硫酸铜吸水后变为蓝色,故答案为:蓝;
(3)有未反应的浓硫酸、苯甲酸,用碳酸钠中和浓硫酸及未反应的苯甲酸而除去,
故答案为:中和浓硫酸及未反应的苯甲酸;
(4)分液要用到的玻璃仪器有分液漏斗、烧杯,苯甲酸乙酯的密度比水大,溶液分层后在下层,
故答案为:分液漏斗、烧杯;下;
(5)温度计控制馏分温度,水银球应在蒸馏烧瓶支管口处,不应插入反应液中,苯甲酸乙酯沸点高,不应该用直形冷凝管,会由温差过大导致破裂,
故答案为:温度计的水银球不应插入反应液中;不应用直型冷凝管;
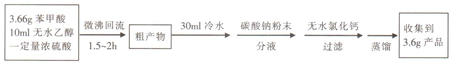
(6)乙醇的质量为10mL×0.789g/mL=7.89g,完全反应需要苯甲酸质量为7.89g×$\frac{122}{46}$=20.93g>3.66g,故苯甲酸乙酯的理论产量为3.66g×$\frac{150}{122}$=4.5g,则产率为$\frac{3.6g}{4.5g}$×100%=80%,
故答案为:80%;
(7)乙中的吸水剂可以吸收反应中产生的水分,有利于提高酯的产率,
故答案为:乙中的吸水剂可以吸收反应中产生的水分,有利于提高酯的产率.
点评 本题考查有机物合成实验,涉及对装置与操作分析评价、物质的分离提纯、对实验条件的控制、对数据的分析处理等,难度中等,需要学生具备扎实的基础与灵活运用能力.

| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
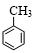 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$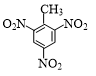 +3H2O.
+3H2O.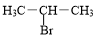 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$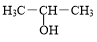 +NaBr.
+NaBr.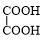 +
+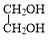 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.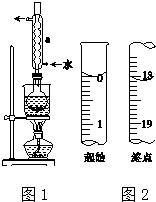 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.