题目内容
13.设阿伏加德罗常数的值为NA,则下列说法正确的是( )| A. | 常温常压下,18.0 g NH4+中所含的质子数为10 NA | |
| B. | 室温下,8 g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 常温下,1 mol/L 的 Na2SO4溶液中含有Na+个数为2NA |
分析 A、求出铵根离子的物质的量,然后根据铵根离子中含11个质子来分析;
B、求出甲烷的物质的量,然后根据甲烷中含4条共价键来分析;
C、常温下,铝在浓硫酸中会钝化;
D、溶液体积不明确.
解答 解:A、18g铵根离子的物质的量为1mol,而铵根离子中含11个质子,故1mol铵根离子中含11NA个质子,故A错误;
B、8g甲烷的物质的量为0.5mol,而甲烷中含4条共价键,故0.5mol甲烷中含2NA条共价键,故B正确;
C、常温下,铝在浓硫酸中会钝化,故不能反应完全,则铝失去的电子小于0.3NA个,故C错误;
D、溶液体积不明确,故溶液中钠离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
3.下列实验事实能用同一原理解释的是( )
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
4.下列富含糖类的是( )


| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
1.下列不属于自发进行的变化是( )
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 水往高处流 | D. | 铁器在潮湿的空气中生锈 |
8.在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )
| A. | 标准状况下,同体积的气体A和气体B的质量比m:n | |
| B. | 25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m | |
| C. | 同温同压下,气体A与气体B密度比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
18.下列说法正确的是( )
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
3.某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中大约要使用470mL NaOH溶液,至少需要称量NaOH固体10.0 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):a、b、e.
Ⅱ.测定中和热:(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、盐酸、NaOH溶液,尚缺少的实验玻璃用品是环形玻璃搅拌棒、温度计.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.①请填写下表中的空白:
②近似认为0.50mol•L-1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=“4.18”J/(g•℃).则中和热△H=-53.5kJ•mol-1 (取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)A、C、D.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中大约要使用470mL NaOH溶液,至少需要称量NaOH固体10.0 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):a、b、e.
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.①请填写下表中的空白:
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)A、C、D.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
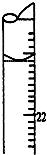 学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:
学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为: 二氧化碳的捕捉和利用是能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是能源领域的一个重要战略方向.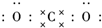 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.