题目内容
17.常温下,NCl3是一种淡黄色的油状液体.下列对NCl3的有关叙述不正确的是( )| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
分析 A.相同非金属原子之间形成的共价键为非极性共价键,不同原子之间形成的为极性共价键,正负电荷中心重合的分子为非极性分子,正负电荷中心不重合的分子为极性分子;
B.根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4;
C.根据元素的最外层电子数+元素的化合价的绝对值=8,该元素就达到8电子稳定结构,否则没有达到8电子稳定结构;
D.氢化物沸点高低是和分子间作用力有关,与化学键无关.
解答 解:A.不同原子之间形成的为极性共价键,NCl3分子中存在N-Cl极性共价键,NCl3分子具有锥形结构,正负电荷中心不重合,所以其为极性分子,故A不选;
B.NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,分子形状为三角锥形,故B不选;
C.NC13中N原子最外层电子数+化合价的绝对值=5+3=8,所以N原子达到8电子稳定结构;NC13中C1原子最外层电子数+化合价的绝对值=7+1=8,所以C1原子达到8电子稳定结构,故C不选;
D.氢化物沸点高低是和分子间作用力有关,与化学键无关,分子晶体,相对分子质量越大,分子间作用力越大,其熔沸点越高,所以NCl3比NF3的熔沸点高,故D选;
故选D.
点评 本题以信息的形式考查NCl3分子空间结构、分子极性、熔沸点等知识,明确信息并结合所学知识即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.在定温、定容条件下,不能标志H2(g)+I2(g)?2HI (g)达平衡的是( )
| A. | 单位时间内消耗amol H2,同时消耗 2amol HI | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器内H2、I2不再减少,HI不再增加 | |
| D. | 单位时间内每生成amol HI,同时a NA个HI分子分解 |
8.下列离子方程式正确的是( )
| A. | 氯化铁溶液中加少量硫氰化钾溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 硫酸铜溶液中加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ | |
| C. | 碘化钾溶液中加过量氯水:2I-+Cl2═I2+2Cl- | |
| D. | 苯酚钠溶液中通少量CO2: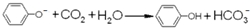 |
5.下列关于卤素(用X表示)的叙述正确的是( )
| A. | 其单质都能与水反应,通式为X2+H2O═HX+HXO | |
| B. | HX易溶于水,其水溶液都是强酸 | |
| C. | 其单质都有颜色,都有毒 | |
| D. | 最高价含氧酸的通式为HXO4 |
12.反应3ClO-+2Fe3++10OH-═2FeO42-+5H2O+3Cl-,下列有关该反应的说法中正确的是( )
| A. | ClO-作还原剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
2.25℃时,0.1mol/L某溶液pH=4,则这溶液可能是( )
| A. | 氨水 | B. | NH4Cl | C. | NaCl | D. | HCl |
9.苹果酸的结构简式为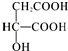 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. | 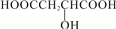 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
6.己知葡萄糖的结构简式为CH2OH(CHOH)4CHO,由此判断下列关于葡萄糖性质的叙述中不正确的是( )
| A. | 葡萄糖能发生酯化反应 | |
| B. | 葡萄糖具有还原性 | |
| C. | 葡萄糖充分燃烧的产物为CO2与H2O | |
| D. | 完全燃烧等质量的葡萄糖和甲醛,所需氧气物质的量不相同 |
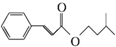 )是一种香料,一种合成路线如图:
)是一种香料,一种合成路线如图: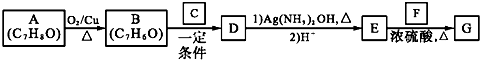
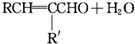
 +CH3CHO$\stackrel{一定条件}{→}$
+CH3CHO$\stackrel{一定条件}{→}$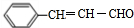 +H2O.
+H2O.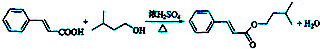 .
.