题目内容
8.下列离子方程式正确的是( )| A. | 氯化铁溶液中加少量硫氰化钾溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 硫酸铜溶液中加过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ | |
| C. | 碘化钾溶液中加过量氯水:2I-+Cl2═I2+2Cl- | |
| D. | 苯酚钠溶液中通少量CO2: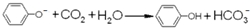 |
分析 A.反应生成络离子,不是沉淀;
B.反应生成[Cu(NH3)4]2+;
C.反应生成碘酸钾;
D.反应生成苯酚和碳酸氢钠.
解答 解:A.氯化铁溶液中加少量硫氰化钾溶液的离子反应为Fe3++3SCN-═Fe(SCN)3,故A错误;
B.硫酸铜溶液中加过量氨水的离子反应为Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O,故B错误;
C.碘化钾溶液中加过量氯水的离子反应为3H2O+I-+3Cl2═IO3-+6Cl-+6H+,故C错误;
D.苯酚钠溶液中通少量CO2的离子反应为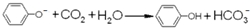 ,故D正确;
,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项BC为解答的难点,题目难度不大.

练习册系列答案
相关题目
18.如表实验操作、现象和结论均正确的是选项实验操作现象结论( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
| C | KNO3和KOH混合溶液中加入铝粉 并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加 Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
16. 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
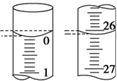
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
依据上表数据计算该H2C2O4溶液的物质的量浓度为0.2610mol/L(保留4位有效数字).
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
13.下列说法不正确的是( )
| A. | 1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳 | |
| B. | 在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 石油的重整可以提高汽油的质量和芳烃的产量 | |
| D. | 往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解 |
17.常温下,NCl3是一种淡黄色的油状液体.下列对NCl3的有关叙述不正确的是( )
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
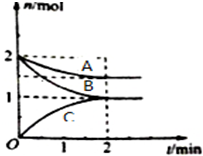 一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示: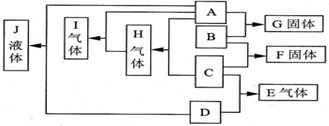
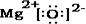 ,其化学键的类型为离子键.
,其化学键的类型为离子键.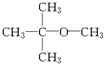 .
.