题目内容
5.下列关于卤素(用X表示)的叙述正确的是( )| A. | 其单质都能与水反应,通式为X2+H2O═HX+HXO | |
| B. | HX易溶于水,其水溶液都是强酸 | |
| C. | 其单质都有颜色,都有毒 | |
| D. | 最高价含氧酸的通式为HXO4 |
分析 A.氟气和水反应生成HF和氧气;
B.HX都易溶于水其中HF溶于水形成的酸为弱酸;
C.单质都有颜色,都是有毒气体;
D.F元素无最高正价.
解答 解;A.氟气和水反应生成HF和氧气,氯气、溴、碘单质与水反应均可用X2+H2O═HXO+HX表示,故A错误;
B.HF溶于水形成的氢氟酸为弱酸,故B错误;
C.氟单质浅黄绿色,氯气黄绿色,溴单质红棕色,碘单质紫黑色,都是有毒气体,故C正确;
D.F元素无最高正价,无最高价含氧酸,Cl、Br、I形成最高价含氧酸的通式为HXO4,故D错误;
故选C.
点评 本题考查卤素单质、化合物知识,为高频考点,侧重于元素化合物的综合理解和运用的考查,题目难度不大,把握卤素原子的结构及其性质.

练习册系列答案
相关题目
15.除去SiO2中混有的少量生石灰和石灰石,有如下操作:( )
①加水溶解 ②加水煮沸 ③过滤 ④加稀HCl.
①加水溶解 ②加水煮沸 ③过滤 ④加稀HCl.
| A. | ①③ | B. | ④③ | C. | ⑤③ | D. | ②③ |
16. 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
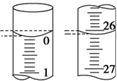
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
依据上表数据计算该H2C2O4溶液的物质的量浓度为0.2610mol/L(保留4位有效数字).
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
13.下列说法不正确的是( )
| A. | 1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳 | |
| B. | 在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 石油的重整可以提高汽油的质量和芳烃的产量 | |
| D. | 往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解 |
10.下列物质的分子中,既有“s_pσ键,又有p_pσ键的是( )
| A. | H2O | B. | OF2 | C. | HClO | D. | N2 |
17.常温下,NCl3是一种淡黄色的油状液体.下列对NCl3的有关叙述不正确的是( )
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
14.某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,核磁共振氢谱显示该分子中有3个吸收峰,该有机物的相对分子质量是60,则该有机物的结构简式是( )
| A. | CH3CH(OH)CH3 | B. | CH3CH2OCH3 | C. | CH3CH2CH2OH | D. | CH3CH2CHO |
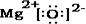 ,其化学键的类型为离子键.
,其化学键的类型为离子键.
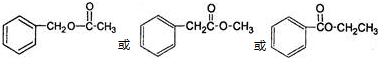 .(任写一种)
.(任写一种)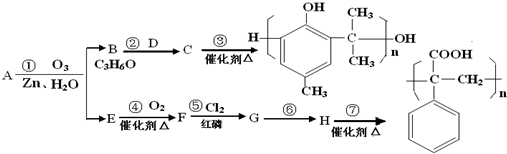
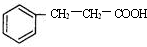 .
. .
.