题目内容
6.己知葡萄糖的结构简式为CH2OH(CHOH)4CHO,由此判断下列关于葡萄糖性质的叙述中不正确的是( )| A. | 葡萄糖能发生酯化反应 | |
| B. | 葡萄糖具有还原性 | |
| C. | 葡萄糖充分燃烧的产物为CO2与H2O | |
| D. | 完全燃烧等质量的葡萄糖和甲醛,所需氧气物质的量不相同 |
分析 A.含有羟基,可发生酯化反应;
B.含有醛基,可发生银镜反应;
C.根据质量守恒定律来分析
D.根据关系式:C6H12O6~6O2,CH2O~O2;
解答 解:A.葡萄糖的结构简式为CH2OH(CHOH)4CHO,分子中含醇羟基能和羧酸发生酯化反应,故A正确;
B.葡萄糖的结构简式为CH2OH(CHOH)4CHO,分子中含醛基,具有还原性能被氧化剂氧化,故B正确;
C.葡萄糖中含有C、H、O,由质量守恒定律可知,完全燃烧的产物是CO2和H2O,故C正确
D.设葡萄糖和甲醛质量都为1g,则
C6H12O6 ~6O2,CH2O~O2;
180 192 30 32
1g $\frac{192}{180}$g=$\frac{32}{30}$g 1g $\frac{32}{30}$g
所以等质量的葡萄糖和甲醛,消耗氧气的量相同,故D错误;
故选D.
点评 本题主要考查了葡萄糖的性质和结构,注意掌握官能团的性质分析判断,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
16. 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
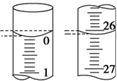
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
依据上表数据计算该H2C2O4溶液的物质的量浓度为0.2610mol/L(保留4位有效数字).
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
17.常温下,NCl3是一种淡黄色的油状液体.下列对NCl3的有关叙述不正确的是( )
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |
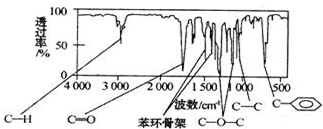
14.某化合物有碳、氢、氧三种元素组成,其红外光谱图有C-H键、O-H键、C-O键的振动吸收,核磁共振氢谱显示该分子中有3个吸收峰,该有机物的相对分子质量是60,则该有机物的结构简式是( )
| A. | CH3CH(OH)CH3 | B. | CH3CH2OCH3 | C. | CH3CH2CH2OH | D. | CH3CH2CHO |
4.被称为“软电池”的纸质电池,采用有关薄层纸片作为一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.总反应的化学方程式为Zn+2MnO2+H2O═Zn(OH)2+Mn2O2,下列说法不正确的是( )
| A. | 该电池为一次电池 | |
| B. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═Mn2O3+2OH- |
 由短周期元素组成的单质A、B、C和四种化合物甲、乙、丙、丁有如图所示的转化关系,已知C是密度最小的气体,甲是电解质.根据图示转化关系回答问题:
由短周期元素组成的单质A、B、C和四种化合物甲、乙、丙、丁有如图所示的转化关系,已知C是密度最小的气体,甲是电解质.根据图示转化关系回答问题: .
. .
.
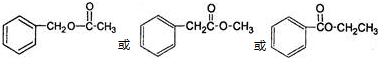 .(任写一种)
.(任写一种)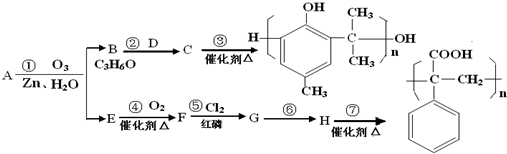
 .
. .
.