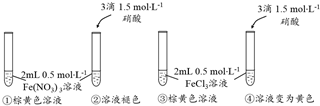
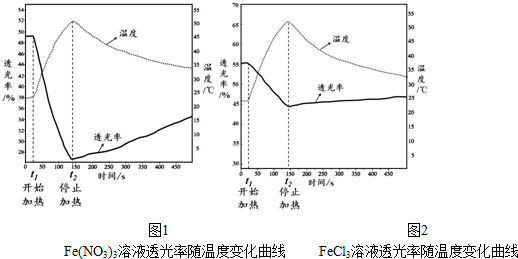
题目内容
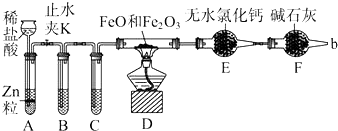
3.金属钛及钛的合金被认为是21世纪重要的金属材料.常温下钛不和非金属、强酸反应.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;△\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如图:
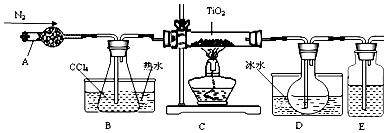
有关物质性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上可以由钛铁矿(FeTiO3)(含Fe2O3等杂质)制备金属Ti.
工业制备过程由钛铁矿经过酸溶解、过滤以及后续一系列化学变化和物理变化,可以将不溶于水的H2TiO3从溶液中过滤出来,再对H2TiO3进行洗涤,最后对H2TiO3进行煅烧得到TiO2,最终获得金属Ti.过程简化如下:
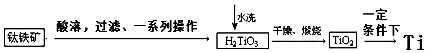
①水洗H2TiO3后,向洗涤液中加滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.
用离子方程式解释“出现微红色”的原因2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3
②以TiO2为原料制取金属钛的其中一步反应为TiO2、氯气和焦炭反应生成TiCl4,己知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO.
③用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气(或惰性气氛中);
所得到的金属钛中混有少量杂质,可加入稀盐酸或稀硫酸溶解后除去.
分析 含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)加硫酸,溶解,过滤,滤液中含有FeSO4(aq)、TiOSO4(aq)和Fe2(SO4)3(aq),加铁粉,把三价铁离子还原为亚铁离子,降温结晶过滤,得到绿矾即硫酸亚铁晶体,滤液为TiOSO4(aq),滤液加热,使TiOSO4水解生成H2TiO3固体,洗涤、干燥、煅烧得到TiO2,在一定条件下,将TiO2还原生成Ti,据此分析解答.
(1)①仪器A是干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气;
②分离两种沸点不同的液体混合物应该用蒸馏;D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法;
(2)①根据亚铁离子的检验操作和现象分析;铁离子和KSCN反应生成血红色溶液,亚铁离子和KSCN不反应,双氧水具有氧化性,能氧化亚铁离子;
②反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,根据电子转移守恒计算碳元素在产物中化合价,据此结合元素守恒判断;
③为防止碳与氧气反应,应可绝空气加热(或惰性气氛中);金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,可用稀盐酸或稀硫酸除杂.
解答 解:(1)①仪器A是干燥管,因为TiCl4遇到水蒸气会水解,所以E中可以用浓硫酸来隔离空气中的水蒸汽,
故答案为:干燥管;浓硫酸;
②D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,但CCl4和TiCl4是两种沸点差异较大的液体混合物,应该用蒸馏进行分离,
故答案为:蒸馏;
(2)①取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,说明没有Fe3+,再加H2O2后出现红色,说明有Fe3+,则原来含有Fe2+,加H2O2后Fe2+被氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3;
②反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,令碳元素在产物中等化合价为a,则a=2×[0-(-1)],故a=2,反应中氧化剂与还原剂的物质的量之比为1:1,结合元素守恒可知,TiO2、Cl2、C、TiCl4的系数分别为1、2、2、1,所以未知物中含有C原子与O原子,碳元素化合价为+2,故为CO,
故答案为:CO;
③为防止碳与氧气反应,应可绝空气加热(或惰性气氛中);金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,可用稀盐酸或稀硫酸除杂,
故答案为:隔绝空气(或惰性气氛中); 稀盐酸或稀硫酸.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

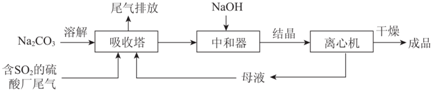
(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
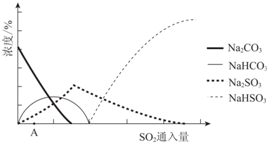
(2)如图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.
(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是B(选填字母).
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:□IO3-+□SO32-=□3SO42-+□1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.
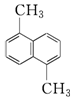 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
能表示该反应已达平衡状态的是( )
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |