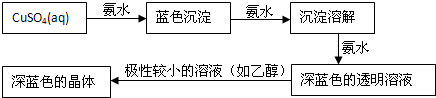
题目内容
水的电离平衡曲线如图所示,下列说法不正确的是( )
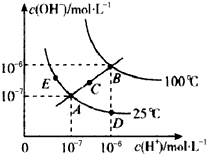

| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
考点:水的电离
专题:
分析:A、由图可知,温度越高,Kw越大,温度升高促进了电离,说明水的电离是吸热反应;
B、加入适量的NH4Cl固体,减小了氢氧根离子的浓度,;
C、C点为中性溶液,Al3+和CO32-相互促进水解,溶液不是中性;
D、E点c(OH-)>c(H+),根据电荷守恒判断.
B、加入适量的NH4Cl固体,减小了氢氧根离子的浓度,;
C、C点为中性溶液,Al3+和CO32-相互促进水解,溶液不是中性;
D、E点c(OH-)>c(H+),根据电荷守恒判断.
解答:
解:A、由图可知,温度越高,Kw越大,温度升高促进了电离,说明水的电离是吸热反应,故A正确;
B、从A点到D点,加入适量的NH4Cl固体,减小了氢氧根离子的浓度,氢离子浓度增大,故B正确;
C、C点为中性溶液,Al3+和CO32-相互促进水解,溶液不是中性,故C错误;
D、E点c(OH-)>c(H+),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)>c(CH3COO-),故D正确;
故选C.
B、从A点到D点,加入适量的NH4Cl固体,减小了氢氧根离子的浓度,氢离子浓度增大,故B正确;
C、C点为中性溶液,Al3+和CO32-相互促进水解,溶液不是中性,故C错误;
D、E点c(OH-)>c(H+),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)>c(CH3COO-),故D正确;
故选C.
点评:本题考查水的电离平衡移动问题,侧重于电荷守恒、水解反应的考查,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小,难度中等.

练习册系列答案
相关题目
具有下列分子式的一溴代烷中,水解后产物在红热铜丝催化下,最多可被空气氧化生成4种不同的醛的是( )
| A、C4H9Br |
| B、C5H11Br |
| C、C6H13Br |
| D、C7H15Br |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA |
| B、精炼铜过程中阳极减轻6.4g时,电路中转移电子数等于0.2NA |
| C、2gD216O中含中子、质子、电子数目均为NA |
| D、标准状况下,11.2L NO和O2的混合气体所含有的分子数为0.5 NA |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、电解精炼铜时,阳极减少6.4g,则转移电子数一定是0.2NA |
常温下,pH=1的盐酸与pH=12的NaOH溶液恰好完全反应,二者的体积比为( )
| A、1:1 | B、10:1 |
| C、100:1 | D、1:10 |
下列物质属于非电解质的是( )
| A、HNO3 |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |