题目内容
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、电解精炼铜时,阳极减少6.4g,则转移电子数一定是0.2NA |
考点:阿伏加德罗常数
专题:
分析:A、根据甲醛和醋酸的最简式均为HCHO来计算;
B、根据Cl2与NaOH的反应是歧化反应;
C、Al3+为弱碱阳离子,会发生水解;
D、粗铜为阳极,粗铜中含有一些比铜活泼的金属也会放电.
B、根据Cl2与NaOH的反应是歧化反应;
C、Al3+为弱碱阳离子,会发生水解;
D、粗铜为阳极,粗铜中含有一些比铜活泼的金属也会放电.
解答:
解:A、甲醛和醋酸的最简式均为HCHO,故30g的混合物中含有的HCHO的物质的量n=
=
=1mol,故含有的碳原子的物质的量为1mol,个数为NA个,故A正确;
B、Cl2与NaOH的反应是歧化反应:Cl2+2NaOH=NaCl+NaClO+H2O,此反应掉1mol氯气时转移1mol电子,故B错误;
C、Al3+为弱碱阳离子,会发生水解导致Al3+个数减小,故C错误;
D、粗铜为阳极,粗铜中含有一些比铜活泼的金属也会放电,故阳极减少的6.4g不只是铜的质量,故则转移电子数不是0.2NA,故D错误.
故选A.
| m |
| M |
| 30g |
| 30g/mol |
B、Cl2与NaOH的反应是歧化反应:Cl2+2NaOH=NaCl+NaClO+H2O,此反应掉1mol氯气时转移1mol电子,故B错误;
C、Al3+为弱碱阳离子,会发生水解导致Al3+个数减小,故C错误;
D、粗铜为阳极,粗铜中含有一些比铜活泼的金属也会放电,故阳极减少的6.4g不只是铜的质量,故则转移电子数不是0.2NA,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列说法中,错误的是( )
| A、化学反应必然伴随发生能量变化,其能量变化主要是由化学键变化引起的 |
| B、化学反应中能量变化的大小与反应物的质量多少无关 |
| C、101kPa下,1mol的纯物质完全燃烧生成稳定的氧化物时的反应热叫燃烧热 |
| D、酸碱稀溶液中和生成1mol水时的反应热叫中和热 |
某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体的一个分子的质量为 g.
(1)该气体的物质的量为
(2)该气体所含原子总数为
(3)该气体的一个分子的质量为
某有机物A 7.4g与足量CuO共热后,所得气体产物依次通过盛有浓H2SO4和碱石灰的仪器,两仪器分别增重9g、17.6g;同温同压,A蒸汽的密度是H2的37倍,则能够与钠反应放出H2的A的同分异构体的数目为(不考虑立体异构)( )
| A、8 | B、6 | C、4 | D、2 |
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子,有关该有机分子的说法正确的是( )

| A、该有机物所有原子一定在同一平面 |
| B、该有机物属于苯的同系物 |
| C、该有机物分子中含有21个碳原子 |
| D、该有机物一氯代物只有4种 |
下列说法正确的是( )
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
水的电离平衡曲线如图所示,下列说法不正确的是( )
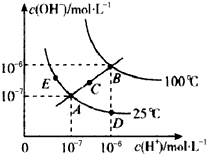

| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m即10-9m~10-7m)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
向硫酸铝溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是( )
| A、NaOH |
| B、NH3?H2O |
| C、NaCl |
| D、MgCl2 |