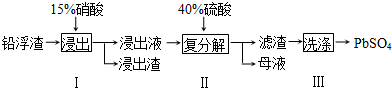
题目内容
对于反应①KHCO3溶液与石灰水反应;②Na2CO3 溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是( )
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
考点:离子方程式的书写
专题:离子反应专题
分析:在溶液中的反应,若反应产物与反应物的量无关时,只发生一个化学反应,反应物相同,生成物也相同,则就能用同一离子方程式表示,若反应产物与反应物的量有关时,不能用同一个离子方程式表示,以此来解答.
解答:
解:①KHCO3少量时,发生反应为:KHCO3+Ca(OH)2═CaCO3↓+H2O+KOH,KHCO3过量时发生反应为:2KHCO3+Ca(OH)2═CaCO3↓+2H2O+K2CO3,反应产物不同,则不能用同一离子方程式表示,故①正确;
②Na2CO3溶液与稀盐酸反应,盐酸量少,反应生成亚硫酸氢钠,离子反应为:CO32-+H+═HCO3-,而盐酸量多时,反应生成二氧化硫和水,离子反应为CO32-+2H+═H2O+CO2↑,不能用同一个离子方程式来表示,故②正确;
③Na与烧碱溶液反应无论以何种量混合,二者反应生成氢氧化钠和氢气,2Na+2H2O═2Na++2OH-+H2↑,可以用同一离子方程式表示,故③错误;
④Fe与稀硝酸反应,Fe不过量生成Fe3+,4H++NO3-+Fe═Fe3++NO↑+2H2O,Fe过量生成Fe2+,8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,不能用同一个离子方程式来表示,故④正确;
故选B.
②Na2CO3溶液与稀盐酸反应,盐酸量少,反应生成亚硫酸氢钠,离子反应为:CO32-+H+═HCO3-,而盐酸量多时,反应生成二氧化硫和水,离子反应为CO32-+2H+═H2O+CO2↑,不能用同一个离子方程式来表示,故②正确;
③Na与烧碱溶液反应无论以何种量混合,二者反应生成氢氧化钠和氢气,2Na+2H2O═2Na++2OH-+H2↑,可以用同一离子方程式表示,故③错误;
④Fe与稀硝酸反应,Fe不过量生成Fe3+,4H++NO3-+Fe═Fe3++NO↑+2H2O,Fe过量生成Fe2+,8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,不能用同一个离子方程式来表示,故④正确;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,题目难度中等,把握发生的化学反应为解答的关键,侧重与量有关的离子反应考查,注重分析能力与知识综合应用能力的训练.

练习册系列答案
相关题目
下列说法正确的是( )
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | ||
| B、分子式为C4H7ClO2可与NaHCO3产生CO2,可能结构有3种 | ||
C、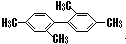 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | ||
D、用
|
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子,有关该有机分子的说法正确的是( )
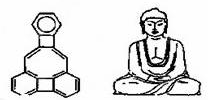

| A、该有机物所有原子一定在同一平面 |
| B、该有机物属于苯的同系物 |
| C、该有机物分子中含有21个碳原子 |
| D、该有机物一氯代物只有4种 |
水的电离平衡曲线如图所示,下列说法不正确的是( )
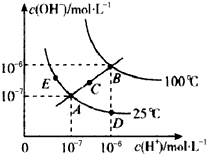

| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
下列说法正确的是( )
| A、在AgNO3溶液中依次滴加同浓度的NaCl、Na2S溶液,可证明KSP(AgCl)>KSP(Ag2S) |
| B、△S>0的反应在一定条件下不一定可以自发进行 |
| C、以Al作阳极,Fe作阴极,可以实现铁上镀铝 |
| D、工业合成SO3不采用高压是因为增大压强对SO2的转化率影响不大 |