题目内容
19.(1)将同为0.01mol/L的下列溶液和水按pH从小到大的顺序用编号排列:①③⑤⑥④②.①H2SO4 ②Ba(OH)2 ③HI ④NH3•H2O ⑤CH3COOH ⑥H2O
(2)pH为4的硫酸溶液浓度为5×10-5mol/L,取20ml该溶液,稀释到2L,此时,溶液的浓度为5×10-7mol/L.pH=6.
分析 (1)溶液中氢离子浓度越大,溶液的pH越小,根据溶液酸碱性按照pH从小到大进行排序;
(2)pH=4的硫酸中氢离子浓度为1×10-4mol/L,根据硫酸的化学式计算出硫酸的浓度;根据稀释过程中溶质的物质的量不变计算出稀释后硫酸的浓度;根据硫酸的化学式计算出氢离子浓度,然后计算出溶液的pH.
解答 解:(1)①H2SO4 ②Ba(OH)2 ③HI ④NH3•H2O ⑤CH3COOH ⑥H2O中,①③⑤为酸溶液,①为二元强酸,③为一元强酸,⑤为弱酸,则三种溶液的平衡从小到大的顺序为:①③⑤;⑥为中性;②④为碱性溶液,且②为二元强碱,④为一元弱碱,则两溶液的pH大小为:②>④,
所以按pH从小到大的顺序用编号排列为:①③⑤⑥④②,
故答案为:①③⑤⑥④②;
(2)pH=4的硫酸中氢离子浓度为1×10-4mol/L,则硫酸的物质的量浓度为:1×10-4mol/L×$\frac{1}{2}$=5×10-5mol/L;
稀释过程中硫酸的物质的量不变,则稀释后硫酸的浓度为:$\frac{5×1{0}^{-5}mol/L×0.02L}{2L}$=5×10-7mol/L,稀释后溶液中氢离子浓度为:5×10-7mol/L×2=1×10-6mol/L,此时溶液的pH=6,
故答案为:5×10-5;5×10-7;6.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol-1,则H2O(g)?H2O(l)的△H=40.69kJ•mol-1 | |||||||||||
| B. | 常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 | |||||||||||
| C. | 已知:
 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384kJ•mol-1 | |||||||||||
| D. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 |
10.将7.4gNa2CO3•10H2O和NaHCO3组成的混合物完全溶解于水配成100mL溶液,测得溶液中c(Na+)=0.6mol/L.若将等质量的混合物与过量盐酸反应后加热蒸干,可以得到固体的质量是( )
| A. | 3.12g | B. | 3.51g | C. | 5.02g | D. | 无法计算 |
7. 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )
 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )| A. | 可能是N2和NO2的混合气体 | B. | 一定是NO2气体 | ||
| C. | 可能是NO和NO2的混合气体 | D. | 只可能是NO2一种气体 |
4.(1)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为杂质)
(2)亚硫酸钠晶体易氧化变质,简述检验亚硫酸钠晶体是否变质的方法取少量亚硫酸钠晶体加蒸馏水溶解,滴入BaCl2溶液,再滴加足量盐酸,若还有白色沉淀,则晶体已变质.
| 物 质 | 加入试剂的化学式 | 有关离子方程式 |
| NaCl(Na2SO4) | ||
| FeCl2(FeCl3) | ||
| Na2CO3 溶液(NaHCO3) |
8.下列各组有机物中,只需加入溴水就能鉴别的是( )
| A. | 甲苯、苯、己烯 | B. | 己炔、己烯、四氯化碳 | ||
| C. | 己烷、苯、乙醇 | D. | 己烯、苯、四氯化碳 |
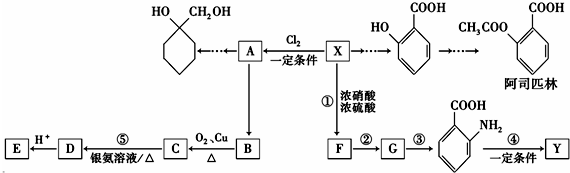

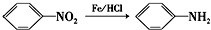 (苯胺,易被氧化)
(苯胺,易被氧化)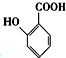 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2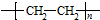
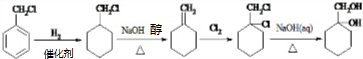 .
. .
.