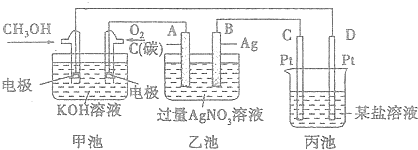
题目内容
3.化合物F是合成抗心律失常药-多非利特的中间体,以苯为原料合成F的路线如下: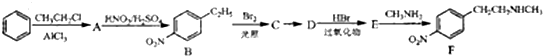
已知:
①CH3CH═CH2$\stackrel{HBr}{→}$CH3CHBrCH3
②CH3CH═CH2$→_{过氧化物}^{HBr}$CH3CH2CH2Br
试回答下列问题:
(1)苯→A、D→E两步转化的反应类型分别是取代反应、加成反应.
(2)化合物C→D转化的反应条件通常是NaOH醇溶液、加热,化合物D不存在(填“存在”、“不存在”)顺反异构,已知化合C的核磁共振氢谱显示有四种峰,且峰的面积比为2:2:1:3,则C的结构简式为
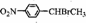 .
.(3)写出E→F的转化的化学方程式
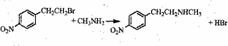 .
.(4)化合B的同分异体有多种,满足以下条件的同分异构体共有3种;
①属于芳香族化合物
②分子结构中没有甲基,但有氨基
③能发生银镜反应和水解反应,并且与NaOH反应的物质的量之比为1:2
(5)苯乙酮(
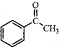 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线 .
.
分析 根据题中各物质转化关系,苯和氯乙烷发生取代反应生成A为 ,
, 发生硝化反应生成B,C的核磁共振氢谱显示有四种峰,且峰的面积比为2:2:1:3,所以B与溴在光照条件下发生取代生成C为
发生硝化反应生成B,C的核磁共振氢谱显示有四种峰,且峰的面积比为2:2:1:3,所以B与溴在光照条件下发生取代生成C为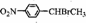 ,C发生消去反应得D为
,C发生消去反应得D为 ,D与溴化氢发生题中信息②中的加成反应生成E为
,D与溴化氢发生题中信息②中的加成反应生成E为 ,E与CH3NH2发生取代生成F,以苯为起始原料制备苯乙酮,可以用苯与氯乙烷发生取代生成乙苯,乙苯与溴发生取代,再碱性水解、氧化可得苯乙酮,据此答题.
,E与CH3NH2发生取代生成F,以苯为起始原料制备苯乙酮,可以用苯与氯乙烷发生取代生成乙苯,乙苯与溴发生取代,再碱性水解、氧化可得苯乙酮,据此答题.
解答 解:根根据题中各物质转化关系,苯和氯乙烷发生取代反应生成A为 ,
, 发生硝化反应生成B,C的核磁共振氢谱显示有四种峰,且峰的面积比为2:2:1:3,所以B与溴在光照条件下发生取代生成C为
发生硝化反应生成B,C的核磁共振氢谱显示有四种峰,且峰的面积比为2:2:1:3,所以B与溴在光照条件下发生取代生成C为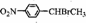 ,C发生消去反应得D为
,C发生消去反应得D为 ,D与溴化氢发生题中信息②中的加成反应生成E为
,D与溴化氢发生题中信息②中的加成反应生成E为 ,E与CH3NH2发生取代生成F,
,E与CH3NH2发生取代生成F,
(1)根据上面的分析可知,苯→A为取代反应,D→E为加成反应,
故答案为:取代反应;加成反应;
(2)化合物C→D转化为卤代烃有消去,反应条件通常是NaOH醇溶液、加热,D为 ,分子中碳碳双键上的一个碳上连有两个氢原子,所以化合物D不存在顺反异构,根据上面的分析可知,C为
,分子中碳碳双键上的一个碳上连有两个氢原子,所以化合物D不存在顺反异构,根据上面的分析可知,C为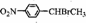 ,
,
故答案为:NaOH醇溶液、加热;不存在;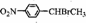 ;
;
(3)E→F的转化的化学方程式为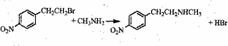 ,
,
故答案为: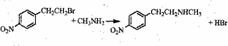 ;
;
(4)根据条件①属于芳香族化合物,即有苯环,②分子结构中没有甲基,但有氨基,③能发生银镜反应和水解反应,并且与NaOH反应的物质的量之比为1:2,说明有甲酸某酸,且水解产物之一为酚,所以符合条件的B的同分异构体为苯环上连有-OOCH、-CH2NH2,它们有邻间对三种,所以共有3种,
故答案为:3;
(5)以苯为起始原料制备苯乙酮,可以用苯与氯乙烷发生取代生成乙苯,乙苯与溴发生取代,再碱性水解、氧化可得苯乙酮,合成路线为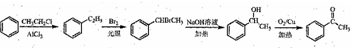 ,
,
故答案为: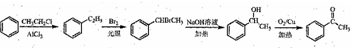 .
.
点评 本题考查有机物的推断与合成,侧重考查学生分析推理能力,要学会根据分子式的变化推断反应的类型,充分利用题信息是解题关键,是对有机化学基础的综合考查,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案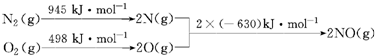
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
| A. | 反应物平衡浓度较大 | B. | 反应越有利于往逆反应方向进行 | ||
| C. | 反应进行的越彻底 | D. | 生成物平衡浓度较小 |
| A. | 铝是地壳中含量最多的金属元素 | |
| B. | 铝单质能与盐酸溶液反应,又能与NaOH溶液反应 | |
| C. | 在常温下,铝不能和氧气反应 | |
| D. | 在化学反应中,铝容易失去电子,是还原剂 |
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |