题目内容
20.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )| A. | 该有机物属于烃 | B. | 该化合物的分子式一定是CH4O | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |
分析 有机物燃烧生成二氧化碳和水,反应前后元素的种类不变,二氧化碳中含有碳元素的质量为8.8g×$\frac{12}{44}$×100%=2.4g,水中含有氢元素的质量为7.2g×$\frac{2}{18}$×100%=0.8g,碳元素和氢元素的质量为2.4g+0.8g=3.2g<6.4g,因此化合物中含有碳、氢、氧三种元素,且C、H、O的原子个数为$\frac{2.4}{12}$:$\frac{0.8}{1}$:$\frac{6.4-3.2}{16}$=1:4:1,以此来解答.
解答 解:A.由上述分析可知,含O元素,为烃的含氧衍生物,故A错误;
B.C、H、O的原子个数为1:4:1,最简式为CH4O,C、H符合饱和烃的特点,则分子式为CH4O,故B正确;
C.由上述分析可知,含O元素,故C错误;
D.由质量守恒可知,有机物含O元素,故D错误;
故选B.
点评 本题考查有机物的分子式确定,为高频考点,把握有机物燃烧规律、质量守恒为解答的关键,侧重分析与计算能力的考查,注意选项B中H达到饱和,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列关于 的说法正确的是( )
的说法正确的是( )
 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有5个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
8.下列有机物,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
| A. | 1-溴丁烷 | B. | 2,2-二甲基-1-丁醇 | ||
| C. | 3-戊醇 | D. | 2-甲基-3-氯戊烷 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(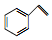 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
5. 用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
 用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )
用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升.下列分析错误的是( )| A. | Al和O2化合放出热量 | B. | 硝酸汞是催化剂 | ||
| C. | 涉及了:2Al+3Hg2+→2Al3++3Hg | D. | “白毛”是氧化铝 |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的最外层电子数是其次外层电子数的三倍,Z元素是光导纤维的组成元素之一,W与Z同主族,R与Y的原子核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
11.以酸性氢氧燃料电池为电源进行电解的实验装置如图.下列叙述正确的是( )
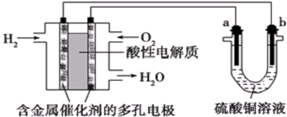

| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- | |
| B. | a极是铁,b极是铜时,铁片表面会镀上一层红色的铜 | |
| C. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
 的单体的结构简式是CH2=CH-CH=CH2和
的单体的结构简式是CH2=CH-CH=CH2和 .
.