题目内容
4.氮化铝(AlN)熔融时不导电、难溶于水,常用作砂轮及耐高温材料,由此推知,它应该属于( )| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
分析 由信息可知,氮化铝常用作砂轮及耐高温的材料,熔融时不导电为共价化合物,熔点高、硬度大,为原子晶体的性质,以此来解答.
解答 解:由信息可知,氮化铝常用作砂轮及耐高温的材料,熔融时不导电为共价化合物,由原子构成,熔点高、硬度大,为原子晶体的性质,所以氮化铝属于原子晶体;故B正确;故选B.
点评 本题考查晶体的判断,明确不同类型晶体的性质是解答本题的关键,难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
14.分别在相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,滴加同一新制氯水.其导电能力随氯水体积变化的曲线如图所示(不考虑空气的影响).下列分析正确的是( )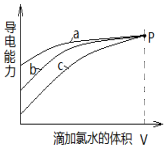

| A. | 曲线a代表H2SO3溶液 | |
| B. | 曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-) | |
| C. | 曲线a、b、c代表的溶液中均始终保持:2c(Cl-)=c(SO42-) | |
| D. | 当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(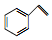 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
12.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的最外层电子数是其次外层电子数的三倍,Z元素是光导纤维的组成元素之一,W与Z同主族,R与Y的原子核外电子数之比为2:1,下列叙述错误的是( )
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
19.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X分别与Y、Z形成10电子的化合物P和Q.P能使湿润的红色石蕊试纸变蓝,Q常温下是一种液体.下列说法正确的是( )
| A. | 简单离子半径大小关系为W>Z | |
| B. | P形成的水溶液能导电,说明P属于电解质 | |
| C. | 电解W的氯化物水溶液可以得到W单质 | |
| D. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
16.下列离子方程式书写不正确的是( )
| A. | AlCl3 溶液与烧碱溶液反应,当 n(OH-):n(Al3+)=7:2 时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2 溶液与 NaHS 溶液反应,当 n(CuCl2):n(NaHS)=1:2 时 Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2 与 FeBr2 溶液反应,当 n(Cl2):n(FeBr2)=1:1 时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe 与稀硝酸反应,当 n(Fe):n(HNO3)=1:2 时,3 Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
14.两种气态烃的混合物共2.24L(标准状况下),完全燃烧后得3.36L(标准状况下)二氧化碳和2.7g的水.下列说法中,正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中一定不含有乙炔 | D. | 混合气体中一定含有乙烷 |
15.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸,碱性最强的化合物的化学式是NaOH.
(2)⑤⑦形成化合物的电子式 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.
(3)最高价氧化物是两性氧化物的元素其元素符号是Al;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是2Al+2H2O+2OH-=2AlO2-+3H2↑.
(5)②和⑦可形成原子数1:2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程: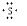 +
+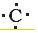 +
+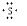 →
→ .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ④ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)⑤⑦形成化合物的电子式
 .②形成的最高价氧化物的结构式O=C=C.
.②形成的最高价氧化物的结构式O=C=C.(3)最高价氧化物是两性氧化物的元素其元素符号是Al;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是2Al+2H2O+2OH-=2AlO2-+3H2↑.
(5)②和⑦可形成原子数1:2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:
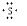 +
+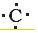 +
+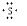 →
→ .
.