题目内容
5.已知:E是石油裂解气的主要成份,它的产量通常用来衡量一个国家的石油化工水平;E能进行如图所示的反应,其中F为高分子化合物.按要求完成下列习题:(要求方程式中有机物必须写结构简式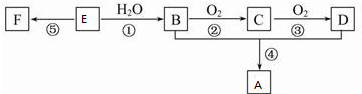
(1)反应②方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应类型氧化反应,A中所含官能团的名称是酯基;
(2)反应①方程式:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,比较反应①剧烈程度<(填>、=或<)钠和水反应的剧烈程度;
(3)反应④方程式:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应类型酯化(或取代)反应;
(4)反应⑤方程式:
 ,反应类型加聚反应.
,反应类型加聚反应.
分析 E是石油裂解气的主要成份,其产量通常用来衡量一个国家的石油化工水平,则E是乙烯,乙烯和水发生加成反应生成B为乙醇,乙醇和氧气反应生成C,则C是乙醛,乙醇与D反应生成乙酸乙酯,则D是乙酸,乙醇、乙酸发生酯化反应生成A为乙酸乙酯,为高分子化合物,应是聚乙烯,以此解答该题.
解答 解:E是石油裂解气的主要成份,其产量通常用来衡量一个国家的石油化工水平,则E是乙烯,乙烯和水发生加成反应生成B为乙醇,乙醇和氧气反应生成C,则C是乙醛,乙醇与D反应生成乙酸乙酯,则D是乙酸,乙醇、乙酸发生酯化反应生成A为乙酸乙酯,为高分子化合物,应是聚乙烯,
(1)反应②是乙醇发生催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,A为乙酸乙酯,含有酯基,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;氧化反应;酯基;
(2)反应①的化学反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,较为缓慢,不如钠与水反应剧烈,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;<;
(3)反应④的化学反应方程为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,为取代反应或酯化反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化(或取代)反应;
(4)乙烯可以发生加聚反应生成聚乙烯,反应为: ,属于加聚反应,
,属于加聚反应,
故答案为: ;加聚反应.
;加聚反应.
点评 本题为有机推断题,侧重考查了常见有机物结构与性质,题目难度中等,注意掌握常见有机物结构与性质,明确常见有机反应概念、反应类型及判断方法,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案| A. | 酸 | B. | 碱 | C. | 盐 | D. | 混合物 |
| A. | Ca2+、Na+、CO32- | B. | Na+、Ca2+、HCO3- | C. | K+、Na+、NO3-. | D. | NH4+、SO42-、Cu2+ |
| A. | 性质(氯水的漂白性);原因(氯气的强氧化性) | |
| B. | 性质(明矾用来净水);原因(Al3+水解生成Al(OH)3胶体,具有吸附性) | |
| C. | 性质(苯燃烧有浓黑的烟);原因(苯分子中含碳量较高) | |
| D. | 性质(加热铝箔,熔化的铝不滴落);原因(氧化膜熔点高,包在熔化的铝外面) |
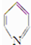 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1molM与金属钠反应,消耗2mol Na | |
| C. | 1mol磷酸吡醛与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
| A. | 加稀盐酸 | B. | 加NaOH溶液 | C. | 焰色反应 | D. | 加热 |
 下表中所示物质或概念间的从属关系符合图1的是( )
下表中所示物质或概念间的从属关系符合图1的是( )


