题目内容
某学生为探究钠与CO2的反应,利用如下装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd).可供选择的药品有:CaCO3(块状)、Na2CO3(粉末)、盐酸、稀硫酸、钠.
(1)请将如图各装置连接完整:②→ → →①→ .(填装置序号)
(2)装置②有孔塑料板上所放的药品是: .
(3)检查装置气密性并装好药品后,当观察到 现象时才点燃酒精灯,此步骤操作的目的是 .
(4)已知CO在潮湿环境中可将PdCl2还原为黑色粉末状的钯(Pd),写出该反应的化学方程式 .
(5)实验过程中CO2足量,装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体.据此现象写出Na与CO2反应的化学方程式: .

(1)请将如图各装置连接完整:②→
(2)装置②有孔塑料板上所放的药品是:
(3)检查装置气密性并装好药品后,当观察到
(4)已知CO在潮湿环境中可将PdCl2还原为黑色粉末状的钯(Pd),写出该反应的化学方程式
(5)实验过程中CO2足量,装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体.据此现象写出Na与CO2反应的化学方程式:
考点:性质实验方案的设计
专题:
分析:(1)根据实验目的:探究钠与CO2的反应,设计实验方案,完成正确的仪器连接顺序;
(2)根据能够控制反应生成的二氧化碳分析;
(3)实验目的是检验钠与二氧化碳的反应,所以需要排净装置中的空气;
(4)根据潮湿环境中吗,PdCl2能被CO还原得到黑色的Pd分析反应生成产物;
(5)根据根据实验现象结合物质的性质判断生成产物.
(2)根据能够控制反应生成的二氧化碳分析;
(3)实验目的是检验钠与二氧化碳的反应,所以需要排净装置中的空气;
(4)根据潮湿环境中吗,PdCl2能被CO还原得到黑色的Pd分析反应生成产物;
(5)根据根据实验现象结合物质的性质判断生成产物.
解答:
解:(1)根据实验目的,先需要准备二氧化碳,选用二氧化碳发生装置为②,为了便于控制反应,选用的药品是块状碳酸钙,所以只能选用稀盐酸,生成的二氧化碳中混有氯化氢氢气,需要经过装置④饱和碳酸氢钠溶液除去杂质氯化氢,然后干燥二氧化碳,选用装置③浓硫酸,干燥后的二氧化碳通入装置①与金属钠反应,反应后的气体利用装置⑤检验,所以正确的连接顺序为:②④③①⑤,故答案为:④、③、⑤;
2)由于使用碳酸钙固体,可以控制生成二氧化碳的反应,所以装置②有孔塑料板上所放的药品是块状的碳酸钙,
故答案为:CaCO3(块状);
(3)反应开始前,需要排尽装置中空气,以免空气中O2、CO2、H2O干扰实验,等到装置⑤中澄清石灰水变浑浊,说明装置中空气已经排净,
故答案为:装置⑤中澄清石灰水变浑浊;排尽装置中空气,以免空气中O2、CO2、H2O干扰实验;
(4)装置⑤PdCl2溶液中观察到有黑色沉淀,说明反应生成了一氧化碳,PdCl2能被CO还原得到黑色的Pd,反应为:PdCl2+CO+H2O=Pd+CO2+2HCl,故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(5)装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,说明生成的固体是碳酸钠,钠与二氧化碳反应生成了碳酸钠和一氧化碳,反应的化学方程式为:2Na+2CO2═Na2CO3+CO,
故答案为:2Na+2CO2═Na2CO3+CO.
2)由于使用碳酸钙固体,可以控制生成二氧化碳的反应,所以装置②有孔塑料板上所放的药品是块状的碳酸钙,
故答案为:CaCO3(块状);
(3)反应开始前,需要排尽装置中空气,以免空气中O2、CO2、H2O干扰实验,等到装置⑤中澄清石灰水变浑浊,说明装置中空气已经排净,
故答案为:装置⑤中澄清石灰水变浑浊;排尽装置中空气,以免空气中O2、CO2、H2O干扰实验;
(4)装置⑤PdCl2溶液中观察到有黑色沉淀,说明反应生成了一氧化碳,PdCl2能被CO还原得到黑色的Pd,反应为:PdCl2+CO+H2O=Pd+CO2+2HCl,故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(5)装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,说明生成的固体是碳酸钠,钠与二氧化碳反应生成了碳酸钠和一氧化碳,反应的化学方程式为:2Na+2CO2═Na2CO3+CO,
故答案为:2Na+2CO2═Na2CO3+CO.
点评:本题考查了探究钠与CO2的反应,难度稍大,涉及了实验装置的连接、化学方程式书写等知识,注意(4)需要根据题中信息判断生成产物,充分考查了学生的分析、理解能力和灵活应用所学知识的能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列实验操作中,溶液里不可能有固体析出的是( )
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )| A、Z元素的原子半径可能比Y元素的小 |
| B、Z的原子序数不可能是X的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的最高价氧化物的水化物的酸性一定比W的强 |
常温常压下,一种气态烷烃与一种气态烯烃的混和物共2升,完全燃烧后,恢复到原状况,得到2.4升二氧化碳.则该混和气体中一定含有( )
| A、甲烷 | B、乙烯 | C、乙烷 | D、丙烯 |
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| B、c(Fe3+)=0.1mol?L-1的溶液中:Na+、NH4+、SCN-、SO42- |
| C、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、0.1mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
向饱和BaSO4 溶液中加水,下列叙述正确的是( )
| A、BaSO4 溶解度增大、Ksp不变 |
| B、BaSO4 溶解度、Ksp均增大 |
| C、BaSO4 溶解度不变、Ksp增大 |
| D、BaSO4 溶解度、Ksp均不变 |
下列说法正确的是( )
| A、在新制的氯水中加入NaOH溶液至中性时,满足c(Na+)=c(ClO-)+c(HClO) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,水解平衡常数Kh增大,而Kw不变 |
| C、常温下,pH=11的某碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合,则:2c(H+)-2c(OH)=C(CH3COO)-C(CH3COOH) |
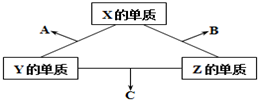 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题: