题目内容
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.(1)在方框中画出元素Y 的原子结构示意图
(2)X与W组成的化合物中存在
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(4)由X、Y、Z、W四种元素组成的一种离子化合物A:
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
①a 取B的溶液加入过量浓NaOH溶液并加热,无色刺激性气味气体和白色沉淀.白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解B的化学式为
②已知1mol?L-1 100mL B的溶液能与1mol?L-1 20mL KMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:在周期表中X是原子半径最小的元素,X应为H元素,Y、Z左右相邻,Z、W位于同主族,设Z的原子序数为x,短周期元素,则有(x-1)+x+(x+8)+1=32,x=8,故Y为N元素,Z为O元素,W为S元素,据此解答各小题即可.
解答:
解:在周期表中X是原子半径最小的元素,X应为H元素,Y、Z左右相邻,Z、W位于同主族,设Z的原子序数为x,短周期元素,则有(x-1)+x+(x+8)+1=32,x=8,故Y为N元素,Z为O元素,W为S元素,综上所述:X为氢,Y为氮,Z为氧,W为硫,
(1)Y为氮,N有2个电子层,最外层电子数是5,故N的原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H与S组成的化合物为硫化氢,其中存在共价键,故答案为:共价;
(3)由氢、氮、氧、硫中的三种组成的能与铜反应的强酸为硝酸,反应的离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(4)①由氢、氮、氧、硫组成的离子化合物可能为硫酸铵、硫酸氢铵、亚硫酸铵、亚硫酸氢铵等,1 mol生成气体2 mol说明一分子这种离子化合物中含有2分子铵根离子,铵根离子与氢氧根离子反应方程式为NH4++OH-
H2O+NH3↑,故答案为:NH4++OH-
H2O+NH3↑;
②此种化合物与氯气反应说明为亚硫酸根离子,故此种化合物为亚硫酸铵,与氯气反应的离子方程式为②SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)①B中含有氢、氮、氧、硫、铁五种元素,取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,说明B中有亚铁离子和铵根离子,B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,说明有硫酸根离子,1mol B中含有6mol结晶水,说明B带六个结晶水,由相对分子质量为392可知道分子式只能为(NH4)2Fe (SO4)2?6H2O,故答案为:(NH4)2Fe (SO4)2?6H2O;
②B的物质的量为0.1 mol,高锰酸根离子的物质的量为0.02 mol,说明亚铁离子与高锰酸根离子以5:1的比例恰好完全反应,故离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(1)Y为氮,N有2个电子层,最外层电子数是5,故N的原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)H与S组成的化合物为硫化氢,其中存在共价键,故答案为:共价;
(3)由氢、氮、氧、硫中的三种组成的能与铜反应的强酸为硝酸,反应的离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(4)①由氢、氮、氧、硫组成的离子化合物可能为硫酸铵、硫酸氢铵、亚硫酸铵、亚硫酸氢铵等,1 mol生成气体2 mol说明一分子这种离子化合物中含有2分子铵根离子,铵根离子与氢氧根离子反应方程式为NH4++OH-
| ||
| ||
②此种化合物与氯气反应说明为亚硫酸根离子,故此种化合物为亚硫酸铵,与氯气反应的离子方程式为②SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)①B中含有氢、氮、氧、硫、铁五种元素,取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,说明B中有亚铁离子和铵根离子,B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,说明有硫酸根离子,1mol B中含有6mol结晶水,说明B带六个结晶水,由相对分子质量为392可知道分子式只能为(NH4)2Fe (SO4)2?6H2O,故答案为:(NH4)2Fe (SO4)2?6H2O;
②B的物质的量为0.1 mol,高锰酸根离子的物质的量为0.02 mol,说明亚铁离子与高锰酸根离子以5:1的比例恰好完全反应,故离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评:本题考查了元素周期表中原子序数之间的关系,并利用原子序数关系来判断元素的种类,根据元素之间形成的价键类型来判断某种分子中的价键类型,根据元素形成的离子具有的性质来推出离子的种类,进而确定化学式等知识点.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列实验操作中,溶液里不可能有固体析出的是( )
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
将2mol SO2和2mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)?2SO3(g),平衡时SO3为W mol.相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
常温常压下,一种气态烷烃与一种气态烯烃的混和物共2升,完全燃烧后,恢复到原状况,得到2.4升二氧化碳.则该混和气体中一定含有( )
| A、甲烷 | B、乙烯 | C、乙烷 | D、丙烯 |
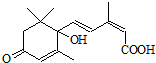 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
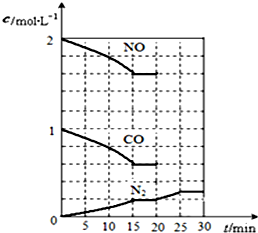 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.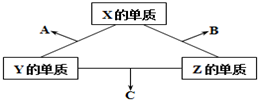 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题: