题目内容
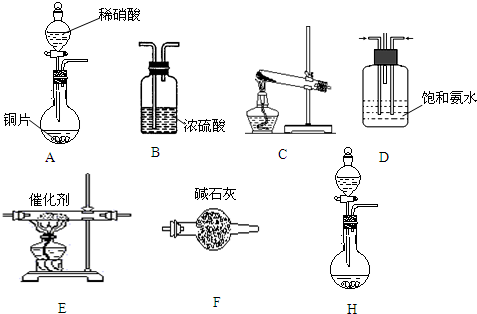
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).(1)制备实验开始时,先检查装置气密性,接下来的操作依次是
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(2)写出实验室制备Cl2的化学方程式
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量.
乙方案:采用酸碱中和滴定法测定.
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量.
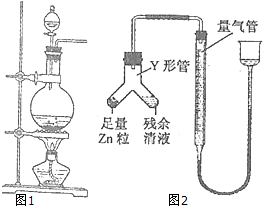
丁方案:与足量Zn反应,测量生成的H2体积.
继而进行下列判断和实验:
①判定甲方案不可行,理由是
②进行乙方案实验:准确量取残余清液稀释一定的倍数后作为试样.
a.量取试样20.00mL,用0.1000mol?L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为
b.平行滴定后获得实验结果.
③判断丙方案的实验结果
[已知:Ksp(CaCO3)=2.8×10-9sp(MnCO3)=2.3×10-11进行丁方案实验:装置如图2示(夹持器具已略去).反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是
考点:氯气的实验室制法
专题:实验题
分析:(1)根据反应物的状态及制取气体的操作步骤进行分析;
(2)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水;工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉;
(3)①甲同学的方案:二氧化锰与浓盐酸反应生成二氯化锰,二氯化锰也会与硝酸银反应,故反应不可行;
②乙同学的方案:依据滴定实验过程中的化学反应定量计算;
③与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
④依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点,使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边.若残余清液转移到左边则会残留在Y型管内壁,导致产生气体的量减少,使测定的盐酸浓度偏小;反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却.
(2)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水;工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉;
(3)①甲同学的方案:二氧化锰与浓盐酸反应生成二氯化锰,二氯化锰也会与硝酸银反应,故反应不可行;
②乙同学的方案:依据滴定实验过程中的化学反应定量计算;
③与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
④依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点,使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边.若残余清液转移到左边则会残留在Y型管内壁,导致产生气体的量减少,使测定的盐酸浓度偏小;反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却.
解答:
解:(1)检查装置气密性后,先加入固体二氧化锰,再加入液体浓盐酸,然后加热,所以检查装置气密性之后的操作依次是:ACB;
故答案为:ACB;
(2)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(3)与足量AgNO3溶液反应,称量生成的AgCl质量,加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度;
故答案为:残余液中的MnCl2也会与AgNO3反应形成沉淀;
②量取试样20.00mL,用0.1000mol?L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得出盐酸的浓度为0.1100mol/L;
故答案为:0.1100;
③根据Ksp(CaCO3)=2.8×10-9sp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
故答案为:偏小;
④丁同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
故答案为:气体未冷却到室温.
故答案为:ACB;
(2)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(3)与足量AgNO3溶液反应,称量生成的AgCl质量,加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度;
故答案为:残余液中的MnCl2也会与AgNO3反应形成沉淀;
②量取试样20.00mL,用0.1000mol?L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得出盐酸的浓度为0.1100mol/L;
故答案为:0.1100;
③根据Ksp(CaCO3)=2.8×10-9sp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
故答案为:偏小;
④丁同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
故答案为:气体未冷却到室温.
点评:本题考查了实验室制备氯气的试剂添加顺序、漂白粉的制备等知识,主要是氯气性质的应用,掌握实验室制取氯气的实验步骤是解答的关键,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写错误的是( )
| A、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、澄清石灰水与盐酸混合:OH-+H+=H2O |
| C、NaOH溶液与CuSO4溶液反应2OH-+Cu2+=Cu(OH)2↓ |
| D、铜与 AgNO3溶液反应 Cu+2Ag+=2Ag+Cu2+ |
下列关于氧化还原反应与四种基本反应类型的关系说法正确的是( )
| A、化合反应都不是氧化还原反应 |
| B、有单质生成的分解反应一定是氧化还原反应 |
| C、有一些置换反应不是氧化还原反应 |
| D、有氧元素参与的复分解反应是氧化还原反应 |
某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为3:8,则关于该气体的说法正确的是( )
| A、该气体一定是纯净物 |
| B、该气体一定是CO、CO2的混合物 |
| C、该气体中所含的物质最多只有2种 |
| D、该气体的组成情况可能有3种组合 |