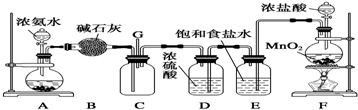
题目内容
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物.请回答:
(1)X元素的名称是 ;Y元素的名称是 ;Z元素的名称是 .
(2)XZ3化合物的电子式是 .
(3)分别写出X、Y的含氧酸的分子式 、 .
(1)X元素的名称是
(2)XZ3化合物的电子式是
(3)分别写出X、Y的含氧酸的分子式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由Y元素原子的最外电子层上的电子数是它的电子层数的2倍,可知Y为C,短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,Y电子层数是2,可知Z为H.且X是两个电子层,再根据X和Z可以形成XZ3的化合物,可知X为N,以此解答该题.
解答:
解:由Y元素原子的最外电子层上的电子数是它的电子层数的2倍,可知Y为C,短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,Y电子层数是2,可知Z为H.且X是两个电子层,再根据X和Z可以形成XZ3的化合物,可知X为N,
(1)由以上分析可知X氮元素、Y为碳元素、Z为氢元素,故答案为:氮;碳;氢;
(2)XZ3的化学式为NH3,氨气是共价化合物,其电子式为: ,故答案为:
,故答案为: ;
;
(3)根据含氧酸的特点,由氮元素和碳元素的含氧酸的分子式为:HNO3 、H2CO3等,故答案为:HNO3 ;H2CO3.
(1)由以上分析可知X氮元素、Y为碳元素、Z为氢元素,故答案为:氮;碳;氢;
(2)XZ3的化学式为NH3,氨气是共价化合物,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)根据含氧酸的特点,由氮元素和碳元素的含氧酸的分子式为:HNO3 、H2CO3等,故答案为:HNO3 ;H2CO3.
点评:本题考查原子的结构与元素周期律的关系,题目难度中等,本题侧重于原子结构与对应化合物的结构和性质的考查,解答时注意原子的结构特点,为解答该题的关键.

练习册系列答案
相关题目
下列说法正确的是( )
| A、1mol氧气中含有1.204×1024个氧原子,通常情况下占有体积约为22.4L |
| B、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| D、欲配制1.00L1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
我国的PM2.5大气环境质量标准即将出台.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中停留时间长,因而对人体健康和大气环境质量影响更大.下列有关说法不正确的是( )
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |
下列关于工业生产说法正确的是 ( )
| A、在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D、工业上采用电解熔融氯化铝的方法制取金属铝 |
| E、石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃 |
短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法正确的是( )
| A、少量金属钾应保存在水中 |
| B、用萃取的方法可除去水中的Cl- |
| C、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D、读取滴定管内液体的体积,俯视读数导致读数偏小 |
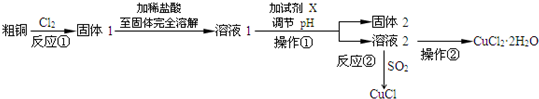
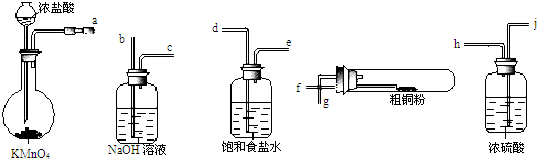
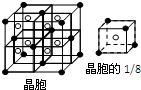 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题: