题目内容
6.雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等.(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.反应的化学方程式为2NO(g)+2CO( g)?N2( g)+2CO2(g).
①已知部分化学键的键能如下:
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
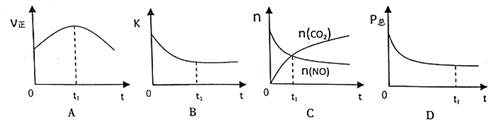
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项字母).(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
③在T℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)是硫酸工业释放出的主要尾气,为减少对环境造成的影响,采用以下方法将其资源化利用,重新获得重要工业产品硫化钙.
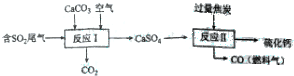
①写出反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
②反应中每生成1mol硫化钙理论上转移电子数为8NA.
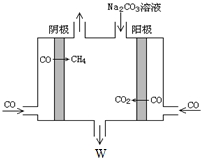
③为充分利用副产品CO,设计电解CO制备CH4和W,工作原理如图所示,生成物W是NaHCO3,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
分析 (1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,据此回答计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③依据平衡常数概念是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积,代入平衡浓度即可计算出平衡常数;根据影响反应速率和平衡移动的因素来回答;
(2)①由流程可知,I中发生2CaCO3+O2+2SO2=2CaSO4+2CO2,硫酸钙中加入碳反应发生反应的化学方程式为:CaSO4+4C=CaS+4CO↑;
②依据化学方程式定量关系和氧化还原反应电子守恒计算转移电子数;
③由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此解答即可.
解答 解:(1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,所以2NO(g)+2CO( g)?N2( g)+2CO2(g)的△H=(2×632+1072×2)-(750×4+946)kJ/mol=-538kJ/mol,
故答案为:-538;
②A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;
B、平衡常数只受温度的影响,反应在恒温、恒容的密闭体系中进行,K始终不变,故B错误;
C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;
D、反应前后气体的系数和变化,所以总压不变的状态达到了平衡状态,故D正确;
故选ABC;
③NO和CO反应生成CO2和N2,反应方程式为:
2NO+2CO?2CO2 +N2
起始浓度:1×l0-2 3.6×l0-2 0 0
转化浓度:0.9×l0-2 0.9×l0-2 0.9×l0-2 0.45×l0-2
平衡浓度:0.1×l0-2 2.7×l0-2 0.9×l0-2 0.45×l0-2
反应的平衡常数K=$\frac{(0.45×1{0}^{-2})(0.9×1{0}^{-2})^{2}}{(0.1×1{0}^{-2})^{2}(2.7×1{0}^{-2})^{2}}$=500,加压既能增大反应速率又能使平衡正向移动,
故答案为:500;加压;
(2)①由流程可知,I中发生2CaCO3+O2+2SO2=2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2=2CaSO4+2CO2;
②硫酸钙中加入碳反应发生反应的化学方程式为:CaSO4+4C=CaS+4CO↑,硫元素化合价+6价变化为-2价,电子转移总数8mol,所以反应中每生成1mol硫化钙理论上转移电子数为8mol,即为8NA,
故答案为:8NA
③由此电解原理可知,阳极失去电子生成二氧化碳气体,加入碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,阴极CO得到电子生成甲烷气体,据此离子反应方程式为:4CO+3CO32-+5H2O=6HCO3-+CH4↑,
故答案为:NaHCO3;4CO+3CO32-+5H2O=6HCO3-+CH4;
点评 本题考查了盖斯定律的应用、化学平衡状态的判断、平衡常数的计算以及影响反应速率的因素等知识,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CS2为直线形的非极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )| A. | “彩雾”是一种混合物 | |
| B. | 上述过程中有物理变化 | |
| C. | 燃料燃烧产生的热量促使拉烟剂气化 | |
| D. | “彩雾”的形成与焰色反应的原理相同 |
| A. | 生石灰和水 | B. | 熟石灰和水 | C. | 浓硫酸和水 | D. | 氯化钠和水 |
| A. | 该元素的相对原子质量的近似值一定是(m+n) | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若12C的质量为Wg,则该原子的质量约为(m+n)Wg | |
| D. | 若NA表示阿伏加德罗常数,则该原子的摩尔质量为(m+n)•NA |
| A. | 分子数和气体质量均不同 | B. | 分子数和中子数均相同 | ||
| C. | 质子数和中子数均相同 | D. | 分子数、原子数和质子数均相同 |
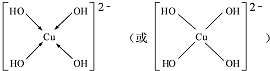 .(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.
.(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.