题目内容
1.某学生实验记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
分析 先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热.
解答 解:第1次实验盐酸和NaOH溶液起始平均温度为$\frac{20.0+20.1}{2}$=20.05℃,反应后温度为:23.4℃,反应前后温度差为3.35℃;
第2次实验盐酸和NaOH溶液起始平均温度为$\frac{20.2+20.4}{2}$=20.3℃,反应后温度为:23.6℃,反应前后温度差为3.3℃;
第3次实验盐酸和NaOH溶液起始平均温度为$\frac{20.5+20.6}{2}$=20.55℃,反应后温度为:23.8℃,反应前后温度差为:3.25℃;
平均温度差为:3.3℃,50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×100g×3.3℃=1.3794kJ,即生成0.025mol的水放出热量为:1.3794kJ,所以中和热△H为:-1.036kJ×$\frac{1.3794kJ}{0.025mol}$=-55.2kJ/mol;
故答案为:-55.2kJ/mol.
点评 本题考查中和热测定的实验计算,注意在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
9.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 将A、B组成原电池时,A为正极 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 将A和B用导线相连接,一同放入CuSO4溶液中,B的表面有红色的铜析出 |
6.雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.反应的化学方程式为2NO(g)+2CO( g)?N2( g)+2CO2(g).
①已知部分化学键的键能如下:
请计算上述反应的△H=-538kJ/mol
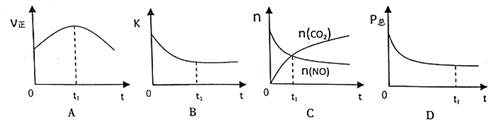
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项字母).(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
③在T℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如下表:
T℃时该反应的平衡常数K=500,既能增大反应速率又能使平衡正向移动的措施是加压(写出一种即可).
(2)是硫酸工业释放出的主要尾气,为减少对环境造成的影响,采用以下方法将其资源化利用,重新获得重要工业产品硫化钙.
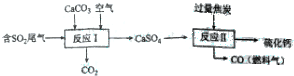
①写出反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
②反应中每生成1mol硫化钙理论上转移电子数为8NA.
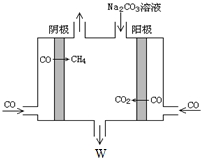
③为充分利用副产品CO,设计电解CO制备CH4和W,工作原理如图所示,生成物W是NaHCO3,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.反应的化学方程式为2NO(g)+2CO( g)?N2( g)+2CO2(g).
①已知部分化学键的键能如下:
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项字母).(下图中V正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)

③在T℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)是硫酸工业释放出的主要尾气,为减少对环境造成的影响,采用以下方法将其资源化利用,重新获得重要工业产品硫化钙.

①写出反应的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
②反应中每生成1mol硫化钙理论上转移电子数为8NA.
③为充分利用副产品CO,设计电解CO制备CH4和W,工作原理如图所示,生成物W是NaHCO3,其原理用电解总离子方程式解释是4CO+3CO32-+5H2O=6HCO3-+CH4↑.

13.下列关于有机物的说法不正确的是( )
| A. | 实验室可用蒸馏法提纯工业乙醇 | |
| B. | 葡萄糖用于制镜业是利用了葡萄糖的还原性 | |
| C. | 1mol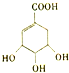 最多可与4 mol NaOH 发生反应 最多可与4 mol NaOH 发生反应 | |
| D. | 1-氯丙烷和2-氯丙烷分别与NaOH 乙醇溶液共热,都可得到丙烯 |
10.下列说法正确的是( )
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H三种核素的性质不同 | |
| B. | 16O2、18O2彼此是同位素 | |
| C. | 14N、14C两种核素的中子数相同,质子数不同 | |
| D. | 白磷与红磷是磷元素的两种同素异形体 |
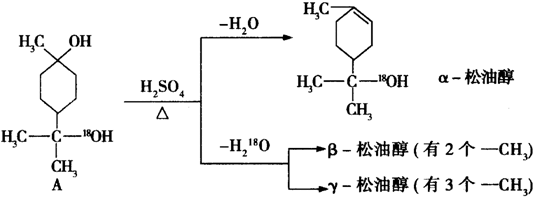
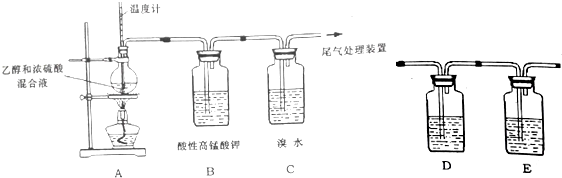
 $→_{△}^{浓硫酸}$
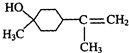
$→_{△}^{浓硫酸}$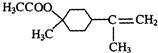 +H2O.
+H2O.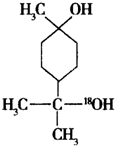 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$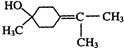 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应. .
. ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H. .
.
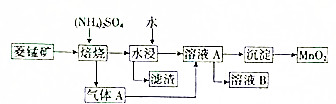 锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):